De aanmaak van een biofilm is een overlevingsstrategie van micro-organismen. Binnen in een biofilm worden micro-organismen beschermd tegen invloeden van buitenaf en het afweersysteem van de gastheer. Pathogene biofilms in de darm leiden echter tot verhoogde oxidatieve stress en toxinenbelasting, waardoor mensen uiteenlopende klachten kunnen krijgen. Ook zijn ze in verband gebracht met ziektes, waaronder darmkanker. De behandeling van een persisterende biofilm is geen sinecure. Gecombineerde aanpak met kruiden en voedingssupplementen kan de effectiviteit verhogen.
Het spijsverteringsstelsel wordt bewoond door een scala aan bacteriën die zowel gunstige als ongunstige effecten hebben op onze gezondheid. Ze bepalen voor een belangrijk deel de balans tussen gezondheid en ziekte. Bacteriën zijn in meer of mindere mate in staat tot de vorming van een biofilm. Een biofilm is een aggregatie van micro-organismen in een biopolymere matrix. Deze matrix is grotendeels van microbiële oorsprong, maar bevat ook (in)organische componenten, zoals mineralen en stoffen die geproduceerd worden door de gastheer. Een biofilm kan zich hechten aan darmepitheel, mucus en voedseldeeltjes.1
Er is geen wetenschappelijke consensus over het bestaan van een functionele, fysiologische biofilm die het volledige darmepitheel bedekt.2 Enerzijds wordt gesteld dat een volledig bedekkende biofilm bijdraagt aan darmhomeostase, kolonisatieresistentie, stabiliteit van het microbioom, maturatie van het afweersysteem en voedselvertering.1 Anderzijds stellen onderzoekers dat een fysiologische biofilm in de darmen beperkt is tot bepaalde plaatsen in de darm, zoals de appendix, en dat volledige bedekking van de darm met een biofilm door de hoge turnover van darmcellen en de glycocalyx niet mogelijk is.2 Ondanks deze discrepantie ziet men dat biofilm in de darm invloed heeft op gezondheid en ziekte en dat het veranderen van de samenstelling van de biofilm een van de eerste markers van ziekte zou kunnen zijn.1,2 Dit wordt bijvoorbeeld gezien bij dikkedarmkanker en inflammatoire darmziekten. Echter, de aanwezigheid van een pathogene biofilm in de darm kan tevens leiden tot andere gezondheidsklachten, waaronder vermoeidheid, verminderde weerstand, huidproblemen, darmklachten en vaginale infecties.
Bacteriën kunnen verschillende leefvormen aannemen, afhankelijk van de omgeving. Ze kunnen voorkomen als vrije organismen (planktonische cellen), volledig opgenomen zijn in een biofilm of recent uitgestoten zijn uit een biofilm.1 De verschillende leefvormen van de bacterie hebben specifieke eigenschappen. Zo is een bacterie uit een biofilm vaker virulenter en resistenter tegen antimicrobiële middelen dan een planktonische bacterie. Bovendien reageert het afweersysteem anders. Het geeft een robuustere respons op vrije bacteriën dan op bacteriën die zich in een biofilm bevinden.1 De leefvorm wordt bepaald door zowel omgevingsfactoren als de gastheer, zoals de aanwezigheid van zuurstof, stikstofoxide, ijzer, proteasen en voedingsstoffen, de invasie van pathogenen en de aanwezigheid van afweercellen.1,3,4
De darmwand wordt tegen (potentiële) pathogenen beschermd door een slijmlaag, de glycocalyx, die op het darmepitheel ligt. Een gezonde glycocalyx is opgebouwd uit polysachariden en glycoproteïnen en bevat antimicrobiële eiwitten die worden geproduceerd door het lichaam of een klein aantal gunstige bacteriën die zich in de slijmlaag bevinden. Verstoringen in de beschermende slijmlaag, bijvoorbeeld door enzymatische afbraak of oxidatieve stress, kunnen leiden tot een verminderde kolonisatieresistentie en de invasie van ziekteverwekkers die een biofilm vormen. De gezonde glycocalyx die de darmwand beschermt, verandert op dit moment van karakter en krijgt pathogene eigenschappen die leiden tot ontsteking, een verhoogde belasting met vrije radicalen en een dysbiose.5
Een biofilm bestaat voor ongeveer 10% uit micro-organismen en de overige 90% is de biofilmmatrix. Deze wordt voornamelijk gevormd door extracellulaire polymere substanties (EPS), bestaande uit polysachariden, eiwitten, nucleïnezuren, vetten, enzymen, DNA, signaalstoffen en extracellulaire bacteriële structuren, zoals flagellen en pili. De stoffen in EPS hebben verschillende functies, waaronder het stimuleren van adhesie en aggregatie van micro-organismen, waterretentie, vorming van een beschermende barrière, absorptie van voedingsstoffen, uitwisseling van genetische informatie (horizontale overdracht van genen tussen micro-organismen) en communicatie tussen bacteriën, ook wel quorum sensing genoemd.1,6 Quorum sensing is essentieel voor de instandhouding van de biofilm. Het wordt gemedieerd door kleine signaalmoleculen die worden vrijgegeven als reactie op veranderingen in de omgeving. De signaalstoffen geven door of micro-organismen gezamenlijk ‘besluiten’ te gaan groeien of toxines te produceren en hebben daarmee invloed op het gedrag van de biofilm.
Pathogene biofilms
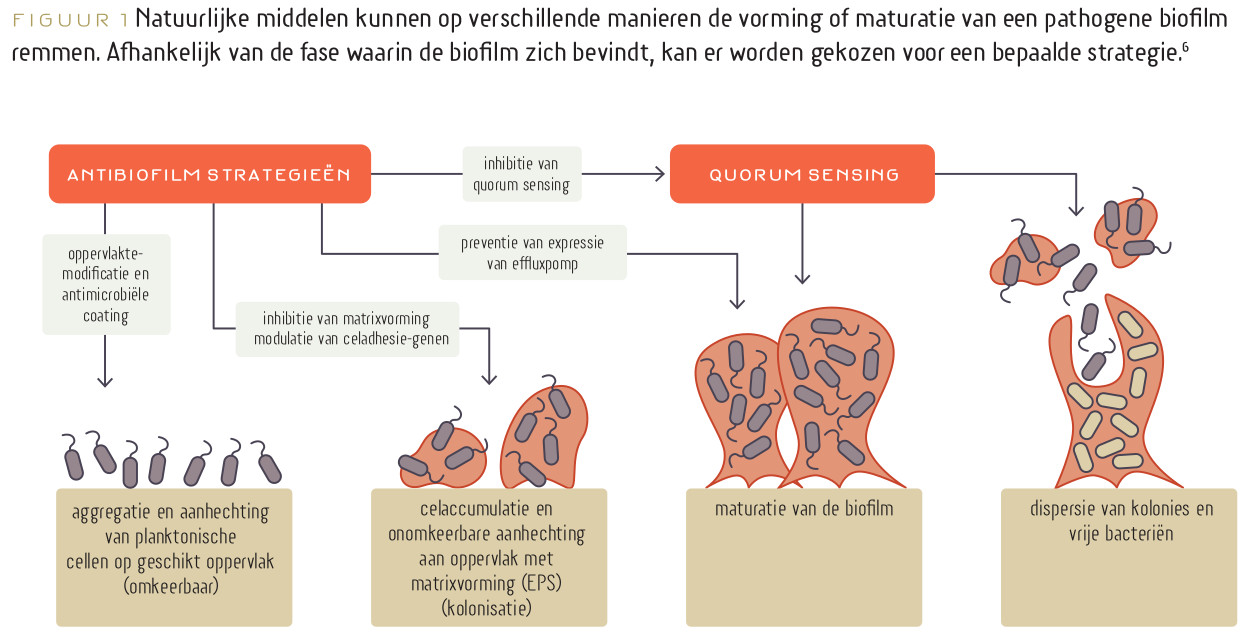
Pathogene biofilms hebben een grote klinische relevantie, omdat het grootste percentage van persisterende infecties wordt veroorzaakt door biofilmvormers zoals Escherichia coli, Pseudomonas aeruginosa, Klebsiella spp., Clostridioides difficile en Candida spp.1,7 Een biofilm vormt zich in vijf stadia.6 Allereerst moeten de bacteriën of schimmels zich hechten aan de gunstige slijmlaag op de darmwand of de darmwand zelf. In deze fase kunnen de pathogenen nog loslaten van het oppervlak. In de tweede fase kan dit niet meer en ondergaat het micro-organisme fenotypische veranderingen, waardoor het pathogeen wordt. Er worden vanaf dan stoffen gevormd die ingebouwd worden in een pathogene biofilm. In de volgende fases wordt de biofilm verder opgebouwd, waarna in de laatste fase er tevens pathogenen worden uitgestoten uit de biofilm. Een pathogene biofilm is invasief en stimuleert een pro-inflammatoire afweerreactie.
Een biofilm kan gevormd worden door een enkel micro-organisme of kan bestaan uit een gemeenschap van verschillende bacteriën en schimmels. Vanwege de diversiteit aan micro-organismen in de darmen bestaat een biofilm daar meestal uit verschillende bacteriën en schimmels.6,8 Micro-organismen halen hier voordeel uit voor hun bestaan, omdat de sterke overlevingseigenschappen van verschillende bacteriën gecombineerd worden. Echter, deze afhankelijkheid van elkaar brengt ook behandelpotentie met zich mee. De Black Queen Hypothesis stelt dat bacteriën bepaalde eigenschappen verliezen en voor essentiële functies sterk leunen op andere soorten in de nabijheid. Lukt het om de biofilm te doorbreken en een belangrijke soort aan te pakken, dan kan dit tot een snellere degradatie van een biofilm leiden.2
Mineralen en de invloed op een biofilm
Verschillende mineralen en sporenelementen zijn belangrijk voor de ontwikkeling en stabilisatie van een pathogene biofilm.4,9,10 Calcium en magnesium zorgen er voor dat de biofilm sterker hecht aan het darmepitheel en stimuleren de verdere ontwikkeling.9 IJzer verhoogt de viscositeit van de biofilm. Daarbij komt dat verschillende pathogene micro-organismen, zoals Klebsiella spp. en E. coli, ijzer gebruiken voor hun groei. Bovendien kan ijzer werken als pro-oxidant en zo biofilmvorming in de hand werken.4,10 Bij de behandeling van een biofilm moet suppletie met mineralen daarom terughoudend worden ingezet. Pas als de biofilm is afgebroken en het darmmicrobioom zich heeft hersteld, zou suppletie voorzichtig kunnen worden overwogen.
Hoe een biofilm aan te pakken
Er zijn verschillende strategieën denkbaar om een biofilm aan te pakken. De beste manier is het voorkomen van de vorming van een biofilm. Probiotica zouden hier mogelijk een rol kunnen spelen. Een nadeel van preventie is dat deze van lange duur is, kosten met zich meebrengt en dat de therapietrouw op de lange termijn niet bijzonder hoog is. Bij bestaande biofilm kan er ingezet worden op het doden van bacteriën, bijvoorbeeld door middel van antibioticagebruik. Het nadeel hiervan is dat antibiotica niet volledig een biofilm kunnen verwijderen, als ze al goed kunnen doordringen in de biofilm. Toepassing van uitsluitend antibiotica werkt daarom antibioticaresistentie in de hand en bemoeilijkt vervolgbehandeling van de biofilm. Er zijn duidelijke aanwijzingen dat het gebruik van verschillende kruiden de effectiviteit van antibiotica bij een persisterende biofilm kan verhogen. Bijvoorbeeld doordat deze kruiden de (expressie van) effluxpompen remmen, waardoor micro-organismen in verhoogde mate worden blootgesteld aan antibiotica/antimycotica. Ook kunnen kruiden de adhesie van bacteriën remmen, de virulentie verminderen en de productie van EPS remmen.11 Een derde methode is het verzwakken van een biofilm.1,7,11 Dit kan door gebruik van kruiden, maar bijvoorbeeld ook door toepassing van enzymen zoals protease, cellulase, tryptase en serrapeptase. Door de biofilm langzaam te ‘verweken’, door middel van surfactants, kunnen antimicrobiële stoffen en afweercellen makkelijker doordringen. Azijnzuur (in een concentratie die nog getolereerd wordt) heeft bijvoorbeeld dit effect, net als ethyleendiaminetetra-azijnzuur (EDTA).1,12 Ook het verstoren van quorum sensing biedt potentie in de behandeling van een biofilm. Door de communicatie tussen micro-organismen te beperken, kan de aanmaak van biofilm worden verstoord.7
***[hier figuur 1 plaatsen]
Verder zou het kunnen helpen om kortdurend chelerende stoffen in te zetten die mineralen wegvangen, waardoor deze niet meer beschikbaar zijn om een biofilm op te bouwen.8,12 Dit kan bijvoorbeeld door middel van een lage dosering EDTA of lactoferrine. Lactoferrine remt tevens de omschakeling van de planktonische staat naar het biofilm fenotype.8 Chelatie met EDTA dient zo kort mogelijk plaats te vinden, omdat langduriger gebruik leidt tot significante mineralentekorten.
Oxidatieve stress lijkt een belangrijke drijfveer te zijn achter de vorming van een pathogene biofilm. Bovendien leiden een gematureerde biofilm en het afbreken van een biofilm tot verhoogde aanwezigheid van vrije radicalen. De inzet van antioxidanten, zoals glutathion, is dan ook op zijn plaats.
Natuurlijke anti-biofilmmiddelen
Vijf klassen van plantenstoffen hebben belangrijke anti-biofilmkwaliteiten: fenolen, essentiële oliën, terpenoïden, lectinen en alkaloïden.7,11 Van de fenolen zijn met name de gecondenseerde tannines (looistoffen) van waarde. Planten uit de kaneel- of kruidnagelfamilie hebben deze anti-biofilmkwaliteiten.7 Arcticum lappa en eucalyptus kunnen de biofilm verweken of gedeeltelijk afbreken.11 Inzet van stoffen die daarnaast of tegelijkertijd antimicrobiële effecten hebben, heeft de voorkeur.7 Afhankelijk van de aard van de biofilm (bacteriën of schimmels) kan de keuze verder worden afgestemd. Denk bijvoorbeeld aan knoflook (gestandaardiseerd op ajuin en allicine), tea tree of oregano (gestandaardiseerd op carvacrol) bij bacteriële biofilm en caprylzuur bij candida-infectie.7,11 Knoflook is niet alleen antimicrobieel, maar remt tevens quorum sensing. Het anthraquinone emodin uit Rheum palmatum en Polygonum cuspidatum remt in de laboratoriumsetting zowel bacteriële als fungale biofilm. Ook Artemisia annua, kurkuma, zwarte komijn, gember, tijm, Scuttelaria baicalensis, EGCG uit groene thee, Cistus incanus en olijfblad hebben sterke antimicrobiële eigenschappen en bestrijden biofilm.7,11 Bovendien werkt een aantal van deze stoffen tevens als antioxidant, wat de vrije radicalen belasting kan verminderen. Tot slot zou naringine uit citrusfruit en kaneel de vorming van EPS kunnen remmen en faciliteert het de diffusie van antimicrobiële middelen.7,11
Klinische effectiviteit van natuurlijke middelen is helaas nog maar zeer beperkt onderzocht en bovengenoemde planten(stoffen) zijn dan ook met name in vitro bekeken. Uit klinisch onderzoek komen niet altijd even duidelijke resultaten. Dit heeft mogelijk te maken met de biologische beschikbaarheid van de planten(stoffen), wat de effectiviteit significant kan verminderen.11
Probiotica: wel of niet?
Het gebruik van probiotica bij de behandeling van een biofilm kent verschillende haken en ogen. Er wordt onderzoek gedaan naar de toepassing van probiotica, omdat met name lactobacillen in staat zijn om een niet-pathogene biofilm te produceren en daarmee adhesie van pathogene bacteriën te blokkeren. Dit zou de toepassing van probiotica zinvol maken om biofilmvorming te voorkomen, maar niet bij de behandeling van een gematureerde biofilm. Andere onderzoeken laten zien dat verschillende probioticastammen de formatie van biofilm kunnen voorkomen, een bestaande biofilm dunner kunnen maken, competitie kunnen aangaan met pathogenen en biofilm antagonistische stoffen kunnen produceren.7,13 Een belangrijk argument tegen het gebruik van probiotica is de horizontale genoverdracht in een biofilm. Mochten probiotica worden opgenomen in de biofilm, dan kunnen zij bepaalde genetische eigenschappen overdragen aan pathogene bacteriën, of genen van pathogene bacteriën overgedragen krijgen en zo zelf in potentie pathogeen worden.1 Een ander argument tegen het gebruik van probiotica is de impermeabiliteit van gematureerde biofilms.1 Dit blokkeert de werking van probiotica. Er zijn nog veel onduidelijkheden rondom het gebruik van probiotica bij ernstige biofilm in de darm en deze dienen dan ook met enige voorzichtigheid te worden ingezet.
Conclusie
Een aanpak waarbij ingezet wordt op verschillende vlakken heeft de voorkeur om resistentie en de ontwikkeling van een persisterende biofilm zo veel mogelijk te voorkomen. Daarnaast is het belangrijk om bij de behandeling van de biofilm het lichaam zo veel mogelijk te ondersteunen in zijn detoxfunctie. Stimuleer lever, nieren en het afweersysteem en suppleer antioxidanten, zodat het lichaam over voldoende middelen beschikt om datgene wat vrijkomt uit de biofilm zo goed mogelijk op te ruimen. De afbraak kan bijvoorbeeld te snel gaan, waardoor de belasting op detoxorganen te hoog wordt. Een aantal middelen die in het artikel worden genoemd, kan te sterk zijn of op termijn bijwerkingen geven, zoals EDTA. Het is daarom belangrijk om tijdens de behandeling de patiënt goed te blijven monitoren op reacties.