Steeds vaker horen we van journalisten, gesteund door hooggeleerden en andere als experts opgevoerde wetenschappers, dat het geen zin heeft om voedingssupplementen te gebruiken. Voorbeelden van journalisten zijn Arjan Lubach, de makers van het tv-programma Radar en een ‘expert’ die zich Sjamadriaan noemt. Het afserveren van supplementen is een onderwerp geworden van volksvermaak. Gebruikt worden kwalificaties zoals ‘weggegooid geld’, ‘kwakzalverij’, ‘oplichterij’ of andere benamingen. Populaire koppen van jut zijn vitamine C en magnesium. Volgens de Voedselconsumptiepeiling 2012-2016 gebruikte, afhankelijk van sekse, leeftijdsgroep en jaargetijde (winter/rest van het jaar), tussen de 30 en 59% van de 19-79-jarigen in Nederland een supplement en dat was voor vitamine C 4-22% en magnesium 2-13%.1 Zouden deze mensen het allemaal bij het verkeerde eind hebben en hoe komt het dat ze zich blijkbaar niets aantrekken van wat deze journalisten en 'experts' hierover in de media hebben te melden?
Wat vooral opvalt, is het gebrek aan feiten en de zwart-witopinies. Niet ongebruikelijk in deze tijd. Door elkaar worden gebruikt begrippen zoals inname en status. In deze bijdrage wordt aandacht besteed aan de huidige innames van magnesium in de Verenigde Staten en Nederland, zoals die kunnen worden beoordeeld uit hun voedselconsumptiepeilingen. De magnesiumstatus zou een beter onderwerp zijn, want die ligt dichter bij magnesiumfunctionaliteit, waar het in werkelijkheid om gaat. Bepaling van de magnesiumstatus is echter een probleem. Hiervoor bestaan (nog) geen goede biomarkers. Bij gebrek aan beter wordt momenteel de status veelal bepaald aan de hand van het totaal plasma-magnesium, terwijl slechts minder dan 1% van het lichaamsmagnesium zich in de extracellulaire ruimte bevindt en dit geen goede afspiegeling is gebleken. Magnesium is vooral intracellulair functioneel en wordt aldaar ook het sterkst gereguleerd. Bij een negatieve magnesiumbalans wordt het plasma-magnesium zo lang mogelijk in stand gehouden door magnesium uit het bot te mobiliseren met als doel om het magnesiumgehalte in de weefsels op peil te houden.2,3 In de appendix wordt hier dieper op ingegaan.
Om de discussie van verifieerbare feiten te voorzien, is er in deze bijdrage voor gekozen om de magnesiuminname in de VS en Nederland te toetsen aan de huidige voedingsnormen van gezaghebbende autoriteiten: (1) het Amerikaanse Institute of Medicine (IOM, tegenwoordig NAM geheten, National Academy of Medicine), (2) de Europese Autoriteit voor voedselveiligheid (EFSA) en (3) de Nordic voedingsnormen (die gelden voor Denemarken, Finland, IJsland, Noorwegen en Zweden). Uiteraard wordt ook gekeken naar wat ons eigen Rijksinstituut voor Volksgezondheid en Milieu (RIVM) hierover zegt.
Beoordeling magnesiuminname
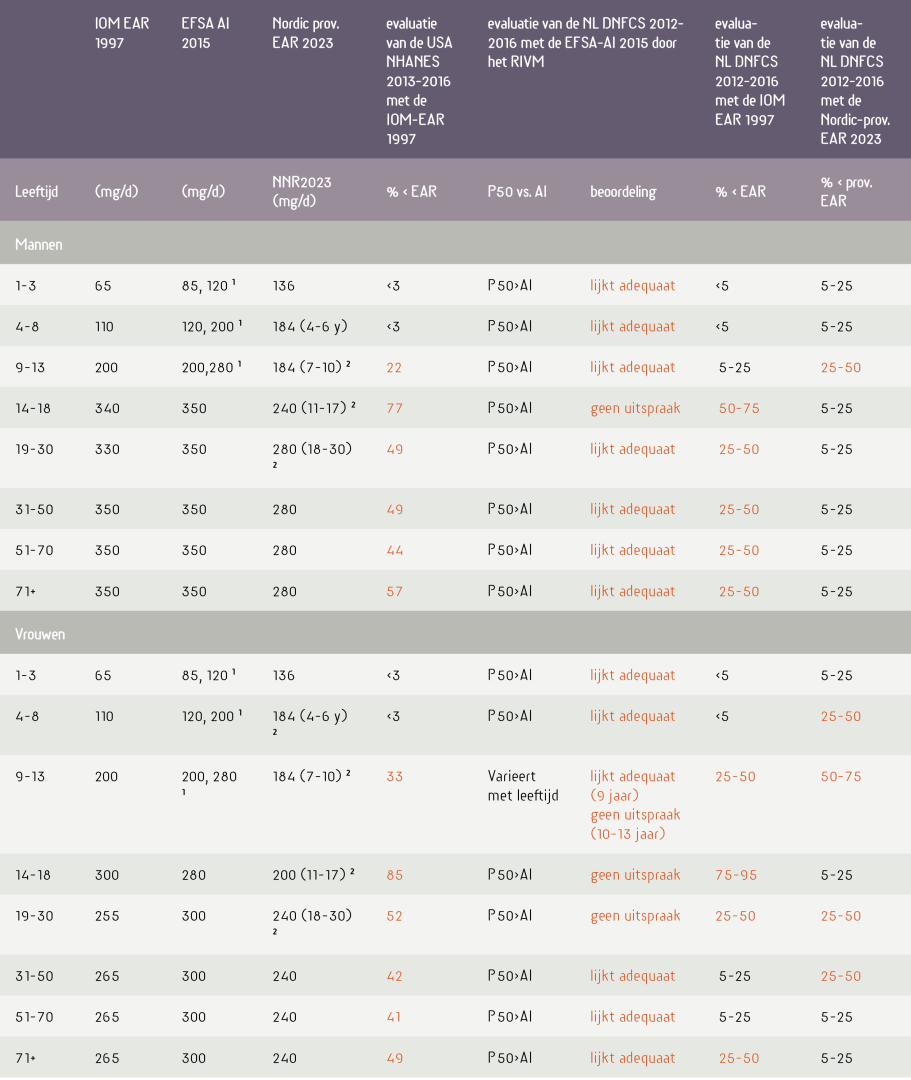
Evaluatie van data uit een voedselconsumptiepeiling vindt plaats door de magnesiuminnames te vergelijken met de magnesium-EAR (estimated average requirement of in het Nederlands ‘gemiddelde behoefte’). Uit de gegevens wordt berekend welk percentage gezonde personen een inname heeft onder de EAR.8 Deze EAR is vastgesteld voor de twee seksen en de verschillende leeftijdsgroepen. In het linkerdeel van tabel 1 zijn de EARs weergegeven van het IOM (IOM EAR 1997)4 en de Noorse landen (Nordic prov. EAR 2023)5. De Nordic provisional EAR 2023 is afgeleid van de EFSA Adequate Inname 2015 (EFSA AI 2015)6. De EFSA heeft voor magnesium geen EAR vastgesteld.
De Nordic prov. EAR is een ‘voorlopige EAR’, wat te maken heeft met de onzekerheid over de vorm van de verdelingscurves van de magnesiumbehoefte. Normaliter gaat men uit van Gaussische verdelingscurves voor de individuele behoeftes. Hierbij is de gemiddelde behoefte de EAR en wordt de ADH (aanbevolen dagelijkse hoeveelheid) berekend door daar twee standaarddeviaties (SDs) bij op te tellen (ADH = EAR + 2SD). De ADH dekt dus de behoefte van 97,5% van de betreffende sekse- en leeftijdsgroep.
Inzake magnesium bestaat onzekerheid over de SD. In zulke gevallen stelt men slechts een adequate inname (AI), die omschreven wordt als: de dagelijkse hoeveelheid van een voedingsstof waarvan wordt aangenomen dat deze voldoende is voor vrijwel alle gezonde mensen in een bepaalde sekse- en leeftijdsgroep. Een AI is hoger dan een ADH. Probleem is dat er bij een AI, per definitie, geen EAR is vastgesteld en de magnesiuminnames dus niet kunnen worden beoordeeld.8 De Nordic landen hebben dit omzeild door in 2023 een ‘provisional EAR’ te definiëren als: 80% van de AI, wat neerkomt op een veronderstelde SD van 12,5%.5 Deze redenering is door het RIVM bij de evaluatie van de Nederlandse voedselconsumptiepeiling 2012-2016 niet gevolgd. Het RIVM hield vast aan een AI en gaf het predicaat seems adequate indien de mediaan-magnesiuminname (P50) van een sekse- en leeftijdsgroep gelijk of hoger was dan de bijbehorende AI (dus P50≥AI). Was P50<Al, dan deed het RIVM geen uitspraak (‘no statement’).1
Voedselconsumptiepeilingen VS en NL
De uitkomsten van de evaluatie zijn weergegeven in het rechterdeel van tabel 1. De beoordeling van de USA NHANES 2013-2016 door het IOM(7) en de NL DNFCS 2012-2016 door het RIVM(1) zijn overgenomen uit de rapporten van respectievelijk het IOM en het RIVM. De evaluaties van de NL DNFCS 2012-2016(1) zijn verricht door ondergetekende, waarbij de IOM EAR 1997(4) en Nordic-prov. EAR 2023(5) zijn geprojecteerd op de verdelingscurves zoals die door het RIVM zijn gepubliceerd.1 Aangezien deze RIVM-gegevens werden weergegeven als de 5e, 25e, 50e, 75e en 95e percentielen (P5, P25, P50, P75, P95) is in tabel 1 aangegeven tussen welke percentielen de respectievelijke EARs zich bevinden.
Opvallend is dat voor alle Amerikanen met een leeftijd boven de 9 jaar het percentage dat een inname heeft onder de EAR, (soms fors) hoger is dan de 10%-norm die door voedingsdeskundigen wordt gehanteerd. Dit onmiskenbare feit wordt reeds jarenlang in de VS gerapporteerd. Die 10% is de afkapgrens waarboven er ‘zorg dient te zijn voor de volksgezondheid’. Deze methode en de 10%-regel staan bekend als de EAR cut-point method.8 Op grond van statistische overwegingen wordt geen potentieel volksgezondheidsprobleem verwacht als minder dan 10% van de deelnemers een gebruikelijke inname heeft die onder de gemiddelde behoefte (dus de EAR) valt.
Zoals uit tabel 1 kan worden afgelezen, moet deze zorg er dus ook zijn voor Nederland.1 Want bij zowel het gebruik van IOM EAR 1997(4) als de Nordic-prov. EAR(5) wordt deze 10%-norm,8 afhankelijk van sekse- en leeftijdsgroep, (soms ruim) overschreden. Het RIVM hield zich strikt aan de regels die voedingsdeskundigen met elkaar hebben bedacht. Ze hanteerden slechts de AI, kunnen daar dus terecht niets mee, en gebruiken derhalve voor hun kwalificaties verhullende taal: ‘lijkt adequaat’, dan wel ‘geen uitspraak’. Wat daar in ieder geval niet staat,1 is: ‘het zit wel goed’. Deze gegevens tonen eenduidig aan dat de vele deskundigen, die zich geruststellend en vaak op nogal denigrerend toon in de media uitspreken over de Nederlandse magnesiuminname, gegevens verspreiden die op gespannen voet staan met de waarheid, zoals dat diplomatiek dient te worden verwoord.
Waarom zijn er verschillen in de beoordelingen?
Die komen bijna geheel op het conto van verschillen in de gehanteerde EARs (zie tabel 1, linkerdeel). Maar er is meer. Het is voor iedereen nuttig, en helemaal voor diegenen die een mening denken te moeten hebben, om de herkomst van de magnesiumvoedingsnormen, en de voedingsnormen in het algemeen, te bestuderen. Je kan die normen onder andere vinden op die potjes met supplementen, maar voor hun achtergrond zal je iets meer moeite moeten doen.
Welke wetenschap ligt hieraan ten grondslag? Hoe weten we wat een mens aan magnesium nodig heeft? Journalisten en hun hooggeleerde zegspersonen hebben het daar nooit over en het vermoeden rijst dat ze de achtergrond van die getalletjes nog nooit hebben gezien. In plaats daarvan hebben ze vaak de mond vol over evidence-based medicine, waarvan ze overigens geen definitie geven (zie verderop).
Magnesiumvoedingsnormen
De EFSA AI 2015(6) en de daarvan afgeleide Nordic-prov. EAR 2023(5) zijn gebaseerd op wat (schijnbaar) gezonde mensen in Europa zoal aan magnesium eten. Zonder bewijs gaat men er dus vanuit dat iedereen eet volgens zijn/haar magnesiumbehoefte. Het gaat om negen landen: Finland, Frankrijk, Duitsland, Ierland, Italië, Letland, Zweden, Verenigd Koninkrijk en ook Nederland. Deze innames werden vervolgens tot een behoeftenorm verheven, nadat de commissie eerst ‘al het beschikbare bewijsmateriaal had overwogen’. Laatstgenoemde komt erop neer dat de enorme berg literatuurgegevens die beschikbaar is over de relaties tussen magnesium en chronische ziektes, collectief werd genegeerd. De uitkomst van de berekeningen werden AI’s(6), en Nordic 2023 maakte hier provisional EARs(5) van. Een middelbare scholier zal begrijpen dat als je zo’n norm vervolgens op de magnesiuminname van één van de bovengenoemde landen projecteert, je zelfgenoegzaam tot de conclusie komt dat zo’n land voldoet aan de norm. Wc-eend kan er nog een hoop van leren ...
Op het eerste gezicht heeft de Amerikaanse magnesiumnorm4 een meer wetenschappelijke basis, maar ook die klopt niet. De IOM-norm is gebaseerd de uitkomsten van een lokale voedselconsumptiepeiling uit 1994. En voor het berekenen van de ADH gebruikte de commissie de standaarddeviatie afkomstig uit ‘balansstudies’. In feite is het verschil tussen de Amerikaanse norm (een ADH) en de Europese norm (een AI) (tabel 1) dus terug te voeren op het verschil in de gemeten magnesiuminname in de VS in 1994(4) en de gemeten magnesiuminname in Europa in de periode 2000-2012.6 Daarbij at Europa domweg minder magnesium dan de VS, dus werd de norm in Europa lager dan in de VS ...
Bij een balansstudie zoekt men naar de ingenomen dosis, gecorrigeerd voor de beschikbaarheid, waarbij er net zoveel magnesium het lichaam in gaat als het lichaam uit, laatstgenoemde vooral via de urine. Het gaat dus om een balans van het lichaam met de buitenwereld (input = output). De denkfout hierbij is dat de uitkomst niets zegt over wat er bij deze ‘balans-met-de-buitenwereld’ in het lichaam zelf aan magnesiumverhuizingen plaatsvinden: de ‘balans-in-het-lichaam’. Daarvoor is het belangrijk dat men nota neemt van de triage-hypothese van dr. Bruce Ames.9-13 Ames stelde, met voorbeelden in onder andere vitamine K en selenium, dat bij dreigende deficiëntie het lichaam de functies gaat prioriteren die belangrijk zijn voor de acute overleving. Dat vergt soms de verhuizing van het kritische nutriënt naar de plaatsen waar het nodig is voor deze acute overleving. Men ziet het onder andere gebeuren in de intensive treatment en het is de reden dat bij een acute-fasereactie, zoals bij een infectie, plasmawaarden niet goed kunnen worden beoordeeld aan de hand van referentiewaarden die afkomstig zijn van gezonde personen. IJzer is het klassieke voorbeeld, maar het geldt ook voor selenium, zink, koper, vitamine C, 25-hydroxyvitamine D en andere nutriënten.61-71
Acute overleving bij dreiging vereist acute ‘aanpassing aan de omstandigheden’ (Darwin). Er ontstaat dan een toestand van ‘allostase’. Deze aanpassingen worden echter schadelijk als ze chronisch worden. De logica van deze ‘hiërarchie in functies’ kennen we allemaal. Bijvoorbeeld. Een acute-stressreactie zorgt voor redistributie van zuurstof en glucose naar de op dat moment belangrijkste organen: spieren en hersenen. Dat is nodig voor de fight, flight & freeze-reactie. Alle acuut optredende hormonale veranderingen (bv. adrenaline, cortisol), en de daarop volgende redistributie van bloed en macronutriënten, zijn daarop gericht. Als acute stress chronisch wordt, gaat de allostatische toestand ten koste van de gezondheid. Een voorbeeld is de anemie die ontstaat vanwege een ijzertekort in het beenmerg bij chronische inflammatie, zoals reumatoïde artritis. Deze ‘anemie vanwege chronische inflammatie’ is iedere dokter bekend. De acute overleving (evolutionair gezien: voor de instandhouding van de reproductie) staat hiërarchisch boven de overleving op lange termijn. Dat is wat de biologen verstaan onder de life history hypothese, die net als de evolutietheorie van Darwin geen hypothese meer is. Het is ook precies wat Ames bedoelde.9-13
Bij een langzaam dalende magnesiumstatus zullen de in de appendix in meer detail weergegeven processen elkaar opvolgen. Het doel is om, bij een bedreigde magnesiumstatus, de cruciale functies van magnesium zo lang mogelijk in stand te houden. Dat zijn de functies in de cellen, alwaar magnesium vooral fungeert als het tweewaardig positieve tegen-ion van de negatief geladen fosfaatverbindingen, waaronder ATP en nucleïnezuren, en dat nog los van de talrijke andere functies van magnesium in bijvoorbeeld enzymen en als calcium-antagonist (zie verderop). Eén van de vele kritische functies van magnesium is zijn rol in de cruciale natrium-kalium-ATPase (nodig voor de membraanpotentiaal), dat het overgrote deel van onze basale energie verstookt, met name in de hersenen en nieren. Bij een uiteindelijke deficiëntie wordt intracellulair magnesium vervangen door calcium en dat wordt reeds lang in verband gebracht met hartziekte, stolling, hartinfarct, vasoconstrictie en hypertensie, verhoogde bloedglucose, insulineresistentie en hyperinsulinemie.14-18 Calcium dient, naast zijn rol in het bot, als signaal-ion (second messenger) en magnesium is de fysiologische calcium-antagonist. In werkelijkheid gaat het niet alleen om magnesium, maar over de verhouding van magnesium tot calcium, maar ook tot fosfaat, natrium, kalium en het zuur-base-evenwicht.19-23
De poging om de intracellulaire magnesium-homeostase te behouden gaat ten koste van de ‘voorraad’ van magnesium in het bot. Daar is het overigens ook grotendeels functioneel omdat het de ‘perfectie’, en daardoor de broosheid, van de hydroxyapatietkristallen voorkómt. De functie van magnesium in het bot staat lager in de hiërarchie dan zijn functie in de zachte weefsels: een tekort in bot vormt immers geen acuut gevaar. Hier is niets vreemd aan. Zo is wijd geaccepteerd dat bot een voorraad vormt van base (in de vorm van bicarbonaat, HCO3-), dat bij een acidose wordt gemobiliseerd om het zeer hoog in de hiërarchie staande zuur-base-evenwicht te behouden. Dat deze compensatie plaatsvindt, zie je (gelukkig) niet aan de pH van het bloed. Die dient onder alle omstandigheden constant te worden gehouden, met andere woorden, die staat hoog in de hiërarchie en is belangrijk voor de kortetermijnoverleving. Het is ook in overeenstemming met een Japans onderzoek, waarbij een natriumbalans met de buitenwereld een negatieve balans veroorzaakte voor magnesium en calcium, dat waarschijnlijk afkomstig was uit het bot. Dit ondanks magnesium- en calciuminnames die in dat onderzoek voldoende zouden moeten zijn.24,25 Je kunt het magnesiummetabolisme dan ook niet los zien van de andere belangrijke mineralen (hier natrium) en ook niet van het zuur-base-evenwicht. Bot fungeert niet alleen als opslagplaats van calcium en base, maar bevat ook relatief veel mobiliseerbaar fosfaat, natrium en kalium.26
Andere tekortkomingen
Naast de ongeschiktheid van referentiewaarden (EFSA, Nordic) en een referentiewaarde/balansstudie (IOM) voor het vaststellen van een magnesiumvoedingsnorm zijn er diverse andere tekortkomingen. Deze zijn verzameld in het kader.
Een belangrijk, hier niet diepgaand besproken, onderwerp is het gebrek aan inzicht in onze evolutie. Magnesium is namelijk overvloedig aanwezig in het zeewater (1.290 mg Mg/L; 411 mg Ca/L). Dit vormt zelfs de reden dat we zeewater niet kunnen drinken zonder over te geven en/of aan de diarree te geraken en daardoor uit te drogen. Het landleven ontstond ongeveer 500 miljoen jaar geleden en dat bestrijkt niet meer dan 12% van de totale evolutie van het leven op deze aarde. De genetica geeft aan dat de anatomisch moderne homo sapiens afkomstig is uit de Zuid-Afrikaanse kust en dat de daaropvolgende out-of Africa-migratie plaatsvond langs de toenmalige kusten en uiteindelijk rivieren tot in het puntje van Zuid-Amerika. Vervanging van een voeding uit het land-zeewaterecosysteem door een voeding die vooral kwam van het land, vond in toenemende mate plaats vanaf ongeveer 10.000 jaar geleden (landbouwrevolutie) en dat is slechts 0,4% van de tijd die is verstreken sinds het ontstaan van het geslacht ‘homo”: ongeveer 2,5 miljoen jaar geleden (homo habilis/erectus).19,20,23a Voor de huidige, anatomisch moderne mens is de vervanging van een voeding uit het land-zeewaterecosysteem door een voeding van het land dus niet meer dan ongeveer 333 generaties geleden.
Voeding uit het land-zeewaterecosysteem (o.a. schelpdieren, zeewier) is magnesiumrijk. Het is dan ook, vanuit onze evolutie geredeneerd, niet verwonderlijk dat er geen enkel hormoon bekend is dat, in tegenstelling tot natrium, kalium, calcium en fosfaat, een directe invloed uitoefent op onze magnesiumstatus. Dat was immers niet nodig: magnesium was er altijd in overvloed en tekorten waren nimmer aan de orde. Er was, net als kalium, eerder sprake van een teveel, dat gemakkelijk via de urine kon worden uitgescheiden. De evolutie steekt geen energie in het ontwerpen van mechanismen (hier: hormonen) die niet voor de homeostase nodig zijn. Omgekeerd maakt het gebrek aan een krachtig mechanisme voor het behoud van de magnesium-homeostase ons kwetsbaar bij een langdurige daling van de magnesiumstatus en/of een ongunstige interactie met andere elementen, vooral calcium (zie verderop). Voorname redenen waarom de magnesiuminname en -status sinds de landbouw/industriële revolutie zijn gedaald zijn: verlaten van het land-zeewaterecosysteem, daling van het magnesiumgehalte in onze gewassen, onvoldoende inname van groente/fruit, en stijging van de calcium/magnesium-ratio in onze voeding, onder andere door een te hoge calciumvoedingsnorm, calciumsupplementen en een hoge calciuminname via de consumptie van melk(producten).19,20
Wordt de huidige magnesiumnorm gehaald door te eten volgens de ‘Schijf van Vijf’?
Het antwoord is een volmondig ja. In een studie van het Voedingscentrum en het RIVM werden de gehaltes aan nutriënten berekend die worden genuttigd indien 85% van de dagelijks benodigde energie wordt gehaald uit voedingsmiddelen die louter behoren tot de ‘Schijf van Vijf’. Uit de modellen bleek dat met zo’n voeding, voor beide seksen en alle leeftijdsgroepen, de dagelijkse inname van magnesium boven de geldende AI voor magnesium ligt.34,34a Eigenhandige toetsing van de berekende Nederlandse magnesiuminnames, gepubliceerd door het Voedingscentrum en het RIVM,34 liet zien dat deze innames, voor de beide seksen en alle leeftijdsgroepen, ook liggen boven zowel de RDAs van het IOM (IOM 1997) en de EFSA/Nordic AIs (Nordic 2023). De resterende 15% van de energie-inname (genaamd ‘de vrije ruimte’)34a zal ook magnesium bevatten, dus in werkelijkheid zal de magnesiuminname nog gunstiger moeten zijn.
De discrepantie met het veelvuldig voorkomen van te lage magnesiuminnames in de Nederlandse bevolking (tabel 1) kan dus niet anders verklaard worden dan dat men zich, zoals bekend, slecht houdt aan de aanbeveling om te eten volgens de ‘Schijf van Vijf’. Magnesium zit in nagenoeg alle voedingsmiddelen, waarbij vooral groenten, granen en noten tot onze belangrijkste magnesiumbronnen zouden moeten behoren. Magnesium is een hoofdbestanddeel van chlorofyl. Noten en granen bevatten relatief veel magnesium want dat zijn de nog ongeboren baby’s van planten. Momenteel halen Nederlanders (1-79 jaar) gemiddeld slechts 3% van hun magnesium uit groentes, peulvruchten, fruit, noten, zaden en olijven en 1% uit vis, schaaldieren en amfibieën. Het meeste magnesium komt uit granen en graanproducten (25%; dus vooral brood) en melkproducten en hun vervangers (17%).1 Dit zijn voedingsmiddelen die tot 10.000 jaar geleden niet door homo sapiens werden gegeten. Hiermee in overeenstemming houdt slechts 27% van de Nederlandse volwassenen zich aan de aanbeveling van de Gezondheidsraad om dagelijks ten minste 200 g groente te eten (huidige gemiddelde: 165 g/dag) en slechts 19% aan het advies van ten minste 200 g fruit (huidige gemiddelde: 130 g/dag).1a Het Voedingscentrum adviseert tenminste 250 g groente per dag en dat zou, afhankelijk van wat er dan minder wordt gegeten, tot een nog hogere magnesiuminname moeten kunnen leiden.
‘Het zit dus wel goed als je maar eet volgend de Schijf van Vijf?’
Dat lijkt inderdaad zo. Daarbij dient echter niet te worden vergeten dat toetsing plaatvond aan de huidige magnesiumvoedingsnormen. ‘Het zit dan wel goed’ gaat echter mank vanwege de wetenschappelijke aanvechtbaarheid van de huidige EARs, RDAs en AI’s voor magnesium. Deze zijn te laag en met name dubieus voor de meeste westerse landen, waar volwassenen veelvuldig melkproducten, dus ook veel calcium (magnesium-antagonist), gebruiken. Een recent voorbeeld uit nogal onverwachte hoek. Gepersonifieerde verlaging van de calcium/magnesiumratio in de voeding naar 2,3 g/g verhoogde in een gerandomiseerd onderzoek bij 60-jarigen de diversiteit van het microbioom, waarbij ook de productie van de ketogene middelketenvetzuren (C7:0, C8:0) steeg.72 Ook steeg in de feces het aandeel van Carnobacterium maltaromaticum en Faecalibacterium prausnitzii, die in mensen een lage vitamine D-status kunnen doen verhogen.74 In een synergistische actie maken deze microben in het colon van vrouwelijke muizen vitamine D en vitamine D-metabolieten die de vitamine D-receptor in het colon activeren en de ontwikkeling van colonkanker onderdrukken.73
Het negeren van ‘all of the evidence’ bij het ontwikkelen van voedingsnormen is niet wat Sackett origineel met zijn evidence-based medicine heeft bedoeld.29 Ze zijn ook niet conform de Hill-criteria voor causaliteit.29a De huidige magnesiumvoedingsnormen van het IOM, de EFSA en de Nederlandse Gezondheidsraad liggen ver af van wat evidence-based mag heten. Toetsing daaraan vertoont veel gelijkenis met het ‘vastklampen aan drijfzand’.
Conclusies
appendix
Wat gebeurt er als een persoon in de tijd steeds minder magnesium gaat eten
- Het plasma-magnesium begint te dalen maar blijft aanvankelijk binnen de referentiewaarden van 0,70-1,10 mmol/L. Referentiewaarden zijn afkomstig van schijnbaar gezonde mensen: het zijn geen optimale waarden. Er ligt geen bewijs dat de deelnemers aan de magnesiumreferentiewaarden magnesium-optimaal waren. Vanwege de daling van de magnesiuminname dreigt er een tekort te ontstaan aan magnesium in de weefsels. In de cellen zit magnesium vooral ionogeen, dus reversibel, gebonden aan fosfaat. In het bot zit magnesium vooral ingesloten in het hydroxyapatietkristal. Het magnesium aan het hydroxyapatietoppervlak, dat dus grenst aan de botvloeistof, kan er ook gemakkelijk weer uit als daaraan wordt getrokken door de rest van het lichaam. Magnesium, natrium en bicarbonaat in het botmineraal zijn beter uitwisselbaar dan calcium en fosfaat.27 Dit komt waarschijnlijk door de slechtere oplosbaarheid van calciumfosfaat (oplosbaarheidsproduct 2,07*10-33) vergeleken met magnesiumfosfaat (1,04*10-24). Het bot houdt het plasma-magnesium (en daarmee het weefselmagnesium) dus lang constant door mobilisatie. De nieren beginnen intussen de terugresorptie op te voeren. Deze maken geen onderscheid tussen magnesium afkomstig uit de voeding, weefsel of het bot.
- De terugresorptie door de nieren is maximaal geworden. Zakt de inname nog verder dan wordt de balans-met-de-buitenwereld negatief. Dit is de magnesiuminname (input=output) die het IOM deels heeft gebruikt voor het vaststellen van hun EAR en daarmee hun RDA. Wat daarbij niet wordt waargenomen is dat een deel van wat in de urine verschijnt afkomstig is uit het bot. In het lichaam vindt verhuizing plaats van magnesium uit het bot naar het plasma met als doel om de niveaus in de weefsels constant te houden. In het lichaam (intern) heerst er dus geen balans: er is sprake van een ‘quasi balans’.3
- Het lichaam loopt nu qua magnesium langzaam leeg, maar dat is nagenoeg niet aan het plasma te zien. Balans met de buitenwereld is dus geen definitie van balans in de binnenwereld, dus in het lichaam. Ook in bot is magnesium functioneel: het verstoort de hydroxyapatiet-structuur waardoor het, vooral uit calciumfosfaat bestaande, kristal niet perfect kan worden. Een perfect kristal is hard maar broos. Het geeft niet mee bij drukbelasting en het breekt. Dit is waarschijnlijk een link van magnesium met osteoporose.
- Als de magnesiuminname in dit gedachte-experiment naar nul daalt zal er nog steeds magnesium in de urine verschijnen. De terugresorptie kan immers nooit 100% zijn: alles lekt. Magnesium komt op dit moment vooral uit het bot, alwaar de functie van magnesium het laagst in de hiërarchie staat. Mensen met type 2-diabetes hebben vanwege de insuline-resistentie en bètacel-disfunctie nog meer moeite om de magnesium-homeostase te bewaren51-60 en meta-analyses van magnesiumsuppletie-studies geven aan dat het vier maanden duurt om hun magnesiumtekort enigszins te herstellen.56,57 Magnesium is nodig voor de secretie van insuline, terwijl insuline het magnesium vanuit het plasma de cel in drijft en calcium de cel uit.59,60
- Uiteindelijk kan het bot het plasmacompartiment niet meer constant houden. Het plasma-magnesium gaat nu dalen en komt beneden de ondergrens van de referentiewaarde van 0,70 mmol/L. Vanwege de reversibele ionogene binding van magnesium aan fosfaat in de cellen beginnen deze nu ook magnesium te verliezen en wordt magnesium aldaar vervangen door calcium. In het referentiewaarde-traject van 0,70-1,10 mmol/L wordt het totaal plasma-magnesium nog enigszins gereguleerd,58 maar een plasma-magnesiumconcentratie zegt natuurlijk niets over de flux (de snelheid van instroom en uitstroom) door het plasma-magnesiumcompartiment. Het plasma-magnesium werd tot op dat moment constant gehouden door mobilisatie van magnesium uit het bot.
- Pas na een daling onder de 0,70 mmol/L wordt een afwijkende magnesiumhomeostase geconstateerd. Het vinden van een plasma-magnesium onder 0,70 mmol/L zal niet vaak voorkomen, vandaar dat een magnesiumbepaling nagenoeg nooit wordt aangevraagd: het is immers ’altijd normaal’ (waarmee wordt bedoeld: ‘binnen de referentiewaarde’). Merkwaardig is dat de overeenkomst met de bloed-pH-regulatie niet wordt gezien. Bij zowel een metabole als respiratoire acidose wordt ook de bloed pH zo lang mogelijk constant gehouden, onder andere door mobilisatie van bicarbonaat (base) uit het bot. Aan de lage urine-pH of de hoge CO2 in de uitademingslucht kan dan worden afgelezen hoeveel moeite het lichaam doet om de bloed-pH constant te houden. Aan het magnesiumgehalte in de urine zie je hoeveel moeite de nieren doen om de magnesium-homeostase in het lichaam te behouden.
- Binnen de ‘plasma-referentiewaarde’ is geen synoniem van een ‘normale waarde’ en het is ook al geen ‘optimale waarde’. Referentiewaarden zijn afkomstig van ‘schijnbaar gezonde’ personen die niet zijn ingesloten op basis van een optimale magnesiumstatus die aan de hand van een ‘gouden standaard’ is vastgesteld. Dat kan ook niet, want die gouden standaard bestaat voor magnesium niet. Het kan niet vaak genoeg worden herhaald dat een plasmaconcentratie niet hetzelfde is als een flux, en dat een hormoonconcentratie niet gelijk is aan een effect.
- Tot nader orde kan de ondergrens voor totaal plasma-magnesium beter worden gesteld op 0,85 mmol/L. Deze baseert zich op de relatie van het plasma-magnesium met tal van ziektes, met name: hart- en vaatziekte (morbiditeit/mortaliteit), hartfalen, ischemische beroerte, atriumfibrilleren en plotse hartdood.28 Tussen de 0,70 en 0,85 mmol/L is sprake van een chronisch latent magnesiumtekort. Deze 0,85 mmol/L afkapgrens vormt het momenteel beste bewijs, wat één van de drie criteria is voor het predicaat ‘evidence-based medicine’.29 Paradoxaal is de kritiek dat de meeste observationele studies niet valide zijn, want van ‘evidence-based medicine’ zou pas sprake zijn als de gegevens zich baseren op interventiestudies en prospectief cohortonderzoek. Bij voorkeur placebo-gecontroleerde gerandomiseerde trials, en als het even kan meerdere eensluidende meta-analyses hiervan. Dit heeft de bedenker van evidence-based medicine (dr. David Sackett) uitdrukkelijk niet zo gesteld,29 en het gaat hier dus om wat criticasters eigenhandig van ‘evidence-based medicine’ hebben gemaakt. De voorgestelde grens van 0,85 mmol/L is plausibel op grond van de boven besproken mechanismen. Begrip van het mechanisme is een belangrijk onderdeel van de ‘Hill-criteria’ voor causaliteit.29a
- Er ligt een voorstel om een te lage magnesiumstatus te baseren op drie criteria: (1) plasma-magnesium <0,85 mmol/L (2,06 mg/dL), (2) urine-magnesiumexcretie <80 mg/dag (3,29 mmol/dag) en (3) magnesiuminname <250 mg/dag (ter vergelijking: de huidige IOM ADH voor mannen is 420 mg/dag en vrouwen 320 mg/dag).30
- De gedachte komt op dat we de instroom van calcium in een cel liever blokkeren met een geneesmiddel (calcium entry blockers, zoals verapamil) dan met magnesium als de natuurlijke calciumantagonist. Deze veelvuldig gebruikte antihypertensiva veroorzaken samen met bètablokkers (propanolol) de meeste sterfgevallen aan geneesmiddelen bij cardiovasculaire ziektes.75 In de bijsluiter staat vermeld dat ze ... niet samen met magnesiumsupplementen moeten worden ingenomen. Bij een eventuele hypotensie vanwege hun combinatie dient calcium te worden gegeven!76
- Interessant is dat de meeste criticasters van supplementen ook sterke voorstanders zijn van ‘preventie’.
Tekortkomingen van de huidige magnesiumvoedingsnormen (EAR, RDA, AI)
Het IOM gebruikte voor hun RDA gegevens uit een Amerikaanse voedselconsumptiepeiling en balansstudies (input = output). De EFSA gebruikte de magnesiuminnames in negen Europese landen en dat zijn dus ook referentiewaarden. Geen van beide geven een waarborg dat dit leidt tot een optimale magnesiumstatus. Een basis in een balansstudie lijkt logisch maar er is biologisch gezien geen reden om aan te nemen dat de evolutie ons op het randje van een tekort heeft doen leven. Integendeel: in het verleden was magnesium uit de voeding waarschijnlijk overvloedig beschikbaar en er is geen enkel hormoon bekend dat de magnesiumhomeostase direct aanstuurt. Subklinische deficiëntie is per definitie niet aan te tonen aan de hand van symptomen en de gerelateerde ziektes openbaren zich op lange termijn. De huidige aanbeveling van het IOM is om voedingsnormen te baseren op het voorkómen van chronische ziekte.31 Onder verwijzing naar ‘evidence-based medicine’ worden de vele gepubliceerde relaties van magnesium met ziektes stelselmatig genegeerd.
Er is geen rekening gehouden met de interactie met calcium. Magnesium is de fysiologische calciumantagonist. Andere interacties zijn die met fosfaat, natrium, kalium en het zuur-base-evenwicht. De calcium/magnesiumverhouding in de voeding is gestegen in de VS en lijkt stabiel te hoog in Nederland. In 2003, 2007-2010 en 2019-2021 bedroegen de calcium/magnesiumverhoudingen in de voeding van Nederlandse mannen ongeveer 2,9; 2,9 en 2,6 g/g, en voor vrouwen 3,45; 3,1 en 3,0 g/g.32,33 Indien 85% van de benodigde energie wordt gehaald uit de ‘Schijf van Vijf’ dan bedraagt, afhankelijk van sekse- en leeftijdsgroep, de calcium/magnesiumratio tussen de 2,6 en 3,7 g/g.34 Echter, het optimum ligt waarschijnlijk rond 2 g/g.18 Belangrijke verstoringen van deze verhouding komen door het gebruik van melk(producten) (calcium/magnesium: menselijke melk 7 g/g, koe: 9,5 g/g)35-37 en calciumsupplementen. Melk is bedoeld voor zuigelingen, want die moeten veel bot (calcium/magnesium=92 g/g) en weefsel (cellen: 3 mmol Mg/L, calcium: 0,0001 mmol/L) aanmaken.38,39
Sinds het vaststellen van de 1997 ADH van het IOM is het gemiddelde lichaamsgewicht van de volwassenen in de meeste, zo niet alle, westerse landen toegenomen. Geschat wordt dat alleen daarom al de aanbeveling 17% hoger dient te zijn voor mannen en 25% hoger voor vrouwen.40
Evolutionair heeft de anatomisch moderne homo sapiens, waar we allemaal uit zijn voortgekomen, geleefd in het land-zeewater-ecosysteem, alwaar magnesium, maar ook kalium, overvloedig aanwezig waren. Ons lichaam is erop gebouwd om de overvloedige magnesium en kalium in onze oervoeding uit te scheiden, en natrium, via het 500 miljoen jaar oude RAAS-systeem, vast te houden, teneinde op het land niet uit te drogen.19,20,23a
De volledige lijst aan referenties kan worden gevonden in referenties 19 en 20.
1. Van Rossum, C. T. M., Buurma-Rethans, E. J. M., Dinnissen, C. S., Beukers, M. H., Brants, H. A. M., & Ocké, M. C. (2020). The diet of the Dutch: Results of the Dutch national food consumption survey 2012-2016.
https://rivm.openrepository.com/entities/publication/5de8226b-7111-44c3-ab8c-25e8da9bb6ce
1a. RIVM. Groente en fruit. Accessed 28 september 2025
2. Vormann J. Magnesium: nutrition and metabolism. Mol Aspects Med. 2003 Feb-Jun;24(1-3):27-37. doi: 10.1016/s0098-2997(02)00089-4. PMID: 12537987.
https://pubmed.ncbi.nlm.nih.gov/12537987/
3. Elin RJ. Assessment of magnesium status for diagnosis and therapy. Magnes Res. 2010 Dec;23(4):S194-8. doi: 10.1684/mrh.2010.0213. Epub 2010 Aug 24. PMID: 20736141.
https://pubmed.ncbi.nlm.nih.gov/20736141/
https://www.wateetnederland.nl/resultaten/richtlijnen/groente-en-fruit
4. Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington (DC): National Academies Press (US); 1997. PMID: 23115811.
https://pubmed.ncbi.nlm.nih.gov/23115811/
5. Blomhoff, R., Andersen, R., Arnesen, E. K., Christensen, J. J., Eneroth, H., Erkkola, M., ... & Trolle, E. (2023). Nordic nutrition recommendations 2023: integrating environmental aspects. Nordic Council of Ministers.
https://books.google.nl/books?hl=nl&lr=&id=bl3jEAAAQBAJ&oi=fnd&pg=PA2&dq=Nordic+Nutrition+Recommendations+2023+&ots=RrZI9XVqIl&sig=I1KkVNUNH50MXSJ87yzicZwHgWw#v=onepage&q=Nordic%20Nutrition%20Recommendations%202023&f=false
6. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). (2015). Scientific opinion on dietary reference values for magnesium. EFSA Journal, 13(7), 4186.
https://efsa.onlinelibrary.wiley.com/doi/abs/10.2903/j.efsa.2015.4186#
7. Moshfegh, A. J., Goldman, J. D., Rhodes, D. G., Clemens, J. C., & LaComb, R. (2013). Usual nutrient intake from food and beverages: What we eat in America. NHANES, 2016, 2019.
https://www.ars.usda.gov/ARSUserFiles/80400530/pdf/usual/Usual_Intake_gender_WW…
8. Murphy, S. P., & Poos, M. I. (2002). Dietary reference intakes: summary of applications in dietary assessment. Public health nutrition, 5(6a), 843-849.
https://nap.nationalacademies.org/catalog/9956/dietary-reference-intakes-applications-in-dietary-assessment
9. Ames BN. Low micronutrient intake may accelerate the degenerative diseases of aging through allocation of scarce micronutrients by triage. Proc Natl Acad Sci U S A. 2006 Nov 21;103(47):17589-94. doi: 10.1073/pnas.0608757103. Epub 2006 Nov 13. PMID: 17101959; PMCID: PMC1693790.
https://pubmed.ncbi.nlm.nih.gov/17101959/
10. McCann JC, Ames BN. Vitamin K, an example of triage theory: is micronutrient inadequacy linked to diseases of aging? Am J Clin Nutr. 2009 Oct;90(4):889-907. doi: 10.3945/ajcn.2009.27930. Epub 2009 Aug 19. PMID: 19692494.
https://pubmed.ncbi.nlm.nih.gov/19692494/
11. Ames BN. Prevention of mutation, cancer, and other age-associated diseases by optimizing micronutrient intake. J Nucleic Acids. 2010 Sep 22;2010:725071. doi: 10.4061/2010/725071. PMID: 20936173; PMCID: PMC2945683.
https://pubmed.ncbi.nlm.nih.gov/20936173/
12. McCann JC, Ames BN. Adaptive dysfunction of selenoproteins from the perspective of the triage theory: why modest selenium deficiency may increase risk of diseases of aging. FASEB J. 2011 Jun;25(6):1793-814. doi: 10.1096/fj.11-180885. Epub 2011 Mar 14. PMID: 21402715.
https://pubmed.ncbi.nlm.nih.gov/21402715/
13. Ames BN. Musings in the twilight of my career. Free Radic Biol Med. 2022 Jan;178:219-225. doi: 10.1016/j.freeradbiomed.2021.11.038. Epub 2021 Dec 1. PMID: 34863877.
https://pubmed.ncbi.nlm.nih.gov/34863877/
14. Resnick LM. Cellular calcium and magnesium metabolism in the pathophysiology and treatment of hypertension and related metabolic disorders. Am J Med. 1992 Aug 31;93(2A):11S-20S. doi: 10.1016/0002-9343(92)90290-r. PMID: 1387762.
https://pubmed.ncbi.nlm.nih.gov/1387762/
15. Barbagallo M, Gupta RK, Dominguez LJ, Resnick LM. Cellular ionic alterations with age: relation to hypertension and diabetes. J Am Geriatr Soc. 2000 Sep;48(9):1111-6. doi: 10.1111/j.1532-5415.2000.tb04788.x. PMID: 10983912.
https://pubmed.ncbi.nlm.nih.gov/10983912/
16. Barbagallo M, Dominguez LJ, Resnick LM. Magnesium metabolism in hypertension and type 2 diabetes mellitus. Am J Ther. 2007 Jul-Aug;14(4):375-85. doi: 10.1097/01.mjt.0000209676.91582.46. PMID: 17667214.
https://pubmed.ncbi.nlm.nih.gov/17667214/
17. Paolisso G, Barbagallo M. Hypertension, diabetes mellitus, and insulin resistance: the role of intracellular magnesium. Am J Hypertens. 1997 Mar;10(3):346-55. doi: 10.1016/s0895-7061(96)00342-1. PMID: 9056694.
https://pubmed.ncbi.nlm.nih.gov/9056694/
18. Rosanoff, A., Capron, E., Barak, P., Mathews, B., & Nielsen, F. (2015). Edible plant tissue and soil calcium: magnesium ratios: data too sparse to assess implications for human health. Crop and Pasture Science, 66(12), 1265-1277.
https://www.publish.csiro.au/cp/cp15085
19. Muskiet FAJ. Calcium-magnesiumratio in de voeding belangrijk voor adequate magnesiumstatus deel 1. Voedingsgeneeskunde 2023;24(3):46-54
https://www.voedingsgeneeskunde.nl/vg-24-3/calcium-magnesiumratio-de-voeding-be…
20. Muskiet FAJ. Calcium-magnesiumratio in de voeding belangrijk voor adequate magnesiumstatus deel 2. Voedingsgeneeskunde 2023:24(4):44-55
https://www.voedingsgeneeskunde.nl/vg-24-4/calcium-magnesiumratio-de-voeding-be…
21. FAJ Muskiet, R. Wisman. Dokter Lubach vertelt en we lachen allemaal. Voedingsgeneeskunde 2023;24(5)38-43
https://www.voedingsgeneeskunde.nl/vg-24-5/dokter-lubach-vertelt-en-we-lachen-a…
22. Muskiet FAJ. Geef magnesiumtekort geen kans. Voorkom calciumtoxiciteit. Uitzicht 2023; 49 (5)10-13.
23. FAJ Muskiet. De optimale calcium-magnesium verhouding.Tijdschrift voor integrale geneeskinde 2024; 39 (2) 95-96
23a. Muskiet, F. A. (2018). Evolutionaire geneeskunde: De groei van onze hersenen heeft ons gevoelig gemaakt voor ‘typisch westerse’ziekten. Bijblijven, 34(5), 391-425.
https://link.springer.com/article/10.1007/s12414-018-0318-2
24. Kodama N, Nishimuta M, Suzuki K. Negative balance of calcium and magnesium under relatively low sodium intake in humans. J Nutr Sci Vitaminol (Tokyo). 2003 Jun;49(3):201-9. doi: 10.3177/jnsv.49.201. PMID: 12953799.
https://pubmed.ncbi.nlm.nih.gov/12953799/
25. Nishimuta M, Kodama N, Shimada M, Yoshitake Y, Matsuzaki N, Morikuni E. Estimated equilibrated dietary intakes for nine minerals (Na, K, Ca, Mg, P, Fe, Zn, Cu, and Mn) adjusted by mineral balance medians in young Japanese females. J Nutr Sci Vitaminol (Tokyo). 2012;58(2):118-28. doi: 10.3177/jnsv.58.118. Erratum in: J Nutr Sci Vitaminol (Tokyo). 2012;58(3):221. PMID: 22790570.
https://pubmed.ncbi.nlm.nih.gov/22790570/
26. Zaichick S, Zaichick V. The effect of age and gender on 38 chemical element contents in human iliac crest investigated by instrumental neutron activation analysis. J Trace Elem Med Biol. 2010 Jan;24(1):1-6. doi: 10.1016/j.jtemb.2009.07.002. Epub 2009 Aug 21. PMID: 20122572.
https://pubmed.ncbi.nlm.nih.gov/20122572/
27. Green J, Kleeman CR. Role of bone in regulation of systemic acid-base balance. Kidney Int. 1991 Jan;39(1):9-26. doi: 10.1038/ki.1991.2. PMID: 1706001.
https://pubmed.ncbi.nlm.nih.gov/1706001/
28. Costello RB, Elin RJ, Rosanoff A, Wallace TC, Guerrero-Romero F, Hruby A, Lutsey PL, Nielsen FH, Rodriguez-Moran M, Song Y, Van Horn LV. Perspective: The Case for an Evidence-Based Reference Interval for Serum Magnesium: The Time Has Come. Adv Nutr. 2016 Nov 15;7(6):977-993. doi: 10.3945/an.116.012765. PMID: 28140318; PMCID: PMC5105038.
https://pubmed.ncbi.nlm.nih.gov/28140318/
29. Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and what it isn't. BMJ. 1996 Jan 13;312(7023):71-2. doi: 10.1136/bmj.312.7023.71. PMID: 8555924; PMCID: PMC2349778.
https://pubmed.ncbi.nlm.nih.gov/8555924/
29a. Hill AB. The environment and disease: association or causation? 1965. J R Soc Med. 2015 Jan;108(1):32-7. doi: 10.1177/0141076814562718. PMID: 25572993; PMCID: PMC4291332.
https://pubmed.ncbi.nlm.nih.gov/25572993/
30. Nielsen FH. Guidance for the determination of status indicators and dietary requirements for magnesium. Magnes Res. 2016 Apr 1;29(4):154-160. doi: 10.1684/mrh.2016.0416. PMID: 28132953.
https://pubmed.ncbi.nlm.nih.gov/28132953/
31. Oria, M. P., & Kumanyika, S. (Eds.). (2017). Guiding principles for developing dietary reference intakes based on chronic disease.
https://books.google.nl/books?hl=nl&lr=&id=sApCDwAAQBAJ&oi=fnd&pg=PR1&dq=Guiding+Principles+for+Developing+Dietary+Reference+Intakes+Based+on+Chronic+Disease&ots=X_jRUQ0a3b&sig=wuX4pdFjmHDQEu-TWm17c87ZQMg#v=onepage&q=Guiding%20Principles%20for%20Developing%20Dietary%20Reference%20Intakes%20Based%20on%20Chronic%20Disease&f=false
32. Van Rossum, C. T. M., Fransen, H. P., Verkaik-Kloosterman, J., & Buurma-Rethans, E. (2007). JM, and Ocke, MC (2011). Dutch National Food Consumption Survey 2007–2010: Diet of Children and Adults Aged 7 to 69 Years.
https://www.rivm.nl/bibliotheek/rapporten/350050006.pdf
33. RIVM De zorg voor morgen begint vandaag. DNFCS2012-2016: Usual intake of macro- and micronutrients from foods only
https://statline.rivm.nl/#/RIVM/nl/dataset/50073NED/table?ts=1583229881203
34. Brink E, van Rossum C, Postma-Smeets A, Stafleu A, Wolvers D, van Dooren C, Toxopeus I, Buurma-Rethans E, Geurts M, Ocké M. Development of healthy and sustainable food-based dietary guidelines for the Netherlands. Public Health Nutr. 2019 Sep;22(13):2419-2435. doi: 10.1017/S1368980019001435. Epub 2019 Jul 2. PMID: 31262374; PMCID: PMC7083597.
https://pubmed.ncbi.nlm.nih.gov/31262374/
34a. Richtlijnen voedselkeuze, Publicatiedatum 1 maart 2011; update 12 april 2011
https://www.voedingscentrum.nl/Assets/Uploads/voedingscentrum/Documents/Profess…
35. Pietrzak-Fiećko R, Kamelska-Sadowska AM. The Comparison of Nutritional Value of Human Milk with Other Mammals' Milk. Nutrients. 2020 May 14;12(5):1404. doi: 10.3390/nu12051404. PMID: 32422857; PMCID: PMC7284997.
https://pubmed.ncbi.nlm.nih.gov/32422857/
36. Dror DK, Allen LH. Overview of Nutrients in Human Milk. Adv Nutr. 2018 May 1;9(suppl_1):278S-294S. doi: 10.1093/advances/nmy022. PMID: 29846526; PMCID: PMC6008960.
https://pubmed.ncbi.nlm.nih.gov/29846526/
37. Association of maternal diet, micronutrient status, and milk volume with milk micronutrient concentrations in Indonesian mothers at 2 and 5 months postpartum_Gibson Am J Clin Nutr. 2020
https://pubmed.ncbi.nlm.nih.gov/32844187/
38. Chekri, R., Noël, L., Millour, S., Vastel, C., Kadar, A., Sirot, V., ... & Guérin, T. (2012). Calcium, magnesium, sodium and potassium levels in foodstuffs from the second French Total Diet Study. Journal of Food Composition and Analysis, 25(2), 97-107.
https://www.sciencedirect.com/science/article/abs/pii/S0889157511002043
39. Schroll, A. (1998). Importance of magnesium for the electrolyte homeostasis–an overview. In Advances in Magnesium Research: Magnesium in Cardiology: Proceedings of the 5th European Congress on Magnesium. London: John Libbey Company (pp. 463-72).
https://scholar.google.nl/scholar?hl=nl&as_sdt=0%2C5&q=Schroll+A.+Importance+of+magnesium+for+the+electrolyte+homeostasis%E2%80%93an+overview.+1998%3B463-72.&btnG=#d=gs_cit&t=1683363895810&u=%2Fscholar%3Fq%3Dinfo%3Ay6dx22Ef0b4J%3Ascholar.google.com%2F%26output%3Dcite%26scirp%3D0%26hl%3Dnl see also http://www.mgwater.com/schroll.shtml
40. Rosanoff A. Perspective: US Adult Magnesium Requirements Need Updating: Impacts of Rising Body Weights and Data-Derived Variance. Adv Nutr. 2021 Mar 31;12(2):298-304. doi: 10.1093/advances/nmaa140. PMID: 33179034; PMCID: PMC8009744.
https://pubmed.ncbi.nlm.nih.gov/33179034/
41. Vijf vragen over magnesium aan Jeroen de Baaij. Wat klopt er van de gezondheidsclaims van influencers op sociale media? 10 oktober 2023; Accessed 28 september 2025
https://www.radboudumc.nl/nieuws/2023/vijf-vragen-over-magnesium-aan-jeroen-de-…
42. de Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev. 2015 Jan;95(1):1-46. doi: 10.1152/physrev.00012.2014. PMID: 25540137.
https://pubmed.ncbi.nlm.nih.gov/25540137/
43. Rosanoff A, West C, Elin RJ, Micke O, Baniasadi S, Barbagallo M, Campbell E, Cheng FC, Costello RB, Gamboa-Gomez C, Guerrero-Romero F, Gletsu-Miller N, von Ehrlich B, Iotti S, Kahe K, Kim DJ, Kisters K, Kolisek M, Kraus A, Maier JA, Maj-Zurawska M, Merolle L, Nechifor M, Pourdowlat G, Shechter M, Song Y, Teoh YP, Touyz RM, Wallace TC, Yokota K, Wolf F; MaGNet Global Magnesium Project (MaGNet). Recommendation on an updated standardization of serum magnesium reference ranges. Eur J Nutr. 2022 Oct;61(7):3697-3706. doi: 10.1007/s00394-022-02916-w. Epub 2022 Jun 10. PMID: 35689124; PMCID: PMC9186275.
https://pubmed.ncbi.nlm.nih.gov/35689124/
44. de Baaij JHF, Bockenhauer D, Claverie-Martin F, Hoenderop JGJ, Hoorn EJ, Houillier P, Knoers NVAM, Konrad M, Müller D, Nijenhuis T, Schlingmann KP, Vargas Poussou R. Comment to "Recommendation on an updated standardization of serum magnesium reference ranges". Eur J Nutr. 2022 Dec;61(8):4231-4233. doi: 10.1007/s00394-022-03004-9. Epub 2022 Sep 27. PMID: 36168067.
https://pubmed.ncbi.nlm.nih.gov/36168067/
45. Touyz RM, Wolf F, Maier JA, Rosanoff A, West C, Elin RJ, Micke O, Baniasadi S, Barbagallo M, Campbell E, Cheng FC, Costello RB, Gamboa-Gomez C, Guerrero-Romero F, Gletsu-Miller N, von Ehrlich B, Iotti S, Kahe K, Kim DJ, Kisters K, Kolisek M, Kraus A, Maj-Zurawska M, Merolle L, Nechifor M, Pourdowlat G, Shechter M, Song Y, Teoh YP, Wallace TC, Yokota K; MaGNet Global Magnesium Project (MaGNet). Reply to "Recommendation on an updated standardization of serum magnesium reference ranges," Jeroen H.F. de Baaij et al. Eur J Nutr. 2022 Dec;61(8):4235-4237. doi: 10.1007/s00394-022-03005-8. Epub 2022 Oct 7. PMID: 36207423.
https://pubmed.ncbi.nlm.nih.gov/36207423/
46. Touyz RM, de Baaij JHF, Hoenderop JGJ. Magnesium Disorders. N Engl J Med. 2024 Jun 6;390(21):1998-2009. doi: 10.1056/NEJMra1510603. PMID: 38838313.
https://pubmed.ncbi.nlm.nih.gov/38838313/
47. Elin RJ. Assessment of magnesium status. Clin Chem. 1987 Nov;33(11):1965-70. PMID: 3315301.
https://pubmed.ncbi.nlm.nih.gov/3315301/
48. Ralston MA, Murnane MR, Kelley RE, Altschuld RA, Unverferth DV, Leier CV. Magnesium content of serum, circulating mononuclear cells, skeletal muscle, and myocardium in congestive heart failure. Circulation. 1989 Sep;80(3):573-80. doi: 10.1161/01.cir.80.3.573. PMID: 2766510.
https://pubmed.ncbi.nlm.nih.gov/2766510/
49. Ryzen E, Elkayam U, Rude RK. Low blood mononuclear cell magnesium in intensive cardiac care unit patients. Am Heart J. 1986 Mar;111(3):475-80. doi: 10.1016/0002-8703(86)90051-7. PMID: 3953355.
https://pubmed.ncbi.nlm.nih.gov/3953355/
50. Schutten JC, Post A, van der Meer M, IJmker J, Goorman F, Danel RM, Vervloet MG, de Borst MH, Touw DJ, Bakker SJL. Comparison of two methods for the assessment of intra-erythrocyte magnesium and its determinants: Results from the LifeLines cohort study. Clin Chim Acta. 2020 Nov;510:772-780. doi: 10.1016/j.cca.2020.09.007. Epub 2020 Sep 11. PMID: 32919943.
https://pubmed.ncbi.nlm.nih.gov/32919943/
51. Gommers LM, Hoenderop JG, Bindels RJ, de Baaij JH. Hypomagnesemia in Type 2 Diabetes: A Vicious Circle? Diabetes. 2016 Jan;65(1):3-13. doi: 10.2337/db15-1028. PMID: 26696633.
https://pubmed.ncbi.nlm.nih.gov/26696633/
52. Kostov K. Effects of Magnesium Deficiency on Mechanisms of Insulin Resistance in Type 2 Diabetes: Focusing on the Processes of Insulin Secretion and Signaling. Int J Mol Sci. 2019 Mar 18;20(6):1351. doi: 10.3390/ijms20061351. PMID: 30889804; PMCID: PMC6470576.
https://pubmed.ncbi.nlm.nih.gov/30889804/
53. de Sousa Melo SR, Dos Santos LR, da Cunha Soares T, Cardoso BEP, da Silva Dias TM, Morais JBS, de Paiva Sousa M, de Sousa TGV, da Silva NC, da Silva LD, Cruz KJC, do Nascimento Marreiro D. Participation of Magnesium in the Secretion and Signaling Pathways of Insulin: an Updated Review. Biol Trace Elem Res. 2022 Aug;200(8):3545-3553. doi: 10.1007/s12011-021-02966-x. Epub 2022 Jun 6. PMID: 35666386.
https://pubmed.ncbi.nlm.nih.gov/35666386/
54. Simental-Mendía LE, Sahebkar A, Rodríguez-Morán M, Guerrero-Romero F. A systematic review and meta-analysis of randomized controlled trials on the effects of magnesium supplementation on insulin sensitivity and glucose control. Pharmacol Res. 2016 Sep;111:272-282. doi: 10.1016/j.phrs.2016.06.019. Epub 2016 Jun 18. PMID: 27329332.
https://pubmed.ncbi.nlm.nih.gov/27329332/
55. Kurstjens S, de Baaij JH, Bouras H, Bindels RJ, Tack CJ, Hoenderop JG. Determinants of hypomagnesemia in patients with type 2 diabetes mellitus. Eur J Endocrinol. 2017 Jan;176(1):11-19. doi: 10.1530/EJE-16-0517. Epub 2016 Oct 5. PMID: 27707767.
https://pubmed.ncbi.nlm.nih.gov/27707767/
56. Asbaghi O, Moradi S, Kashkooli S, Zobeiri M, Nezamoleslami S, Hojjati Kermani MA, Lazaridi AV, Miraghajani M. The effects of oral magnesium supplementation on glycaemic control in patients with type 2 diabetes: a systematic review and dose-response meta-analysis of controlled clinical trials. Br J Nutr. 2022 Dec 28;128(12):2363-2372. doi: 10.1017/S0007114521005201. Epub 2022 Jan 20. PMID: 35045911.
https://pubmed.ncbi.nlm.nih.gov/35045911/
57. Drenthen LCA, de Baaij JHF, Rodwell L, van Herwaarden AE, Tack CJ, de Galan BE. Oral magnesium supplementation does not affect insulin sensitivity in people with insulin-treated type 2 diabetes and a low serum magnesium: a randomised controlled trial. Diabetologia. 2024 Jan;67(1):52-61. doi: 10.1007/s00125-023-06029-9. Epub 2023 Nov 3. PMID: 37922013; PMCID: PMC10709477.
https://pubmed.ncbi.nlm.nih.gov/37922013/
58. Kröse JL, de Baaij JHF. Magnesium biology. Nephrol Dial Transplant. 2024 Nov 27;39(12):1965-1975. doi: 10.1093/ndt/gfae134. Erratum in: Nephrol Dial Transplant. 2025 May 30;40(6):1261. doi: 10.1093/ndt/gfae219. PMID: 38871680; PMCID: PMC11648962.
https://pubmed.ncbi.nlm.nih.gov/38871680/
59. Paolisso G, Barbagallo M. Hypertension, diabetes mellitus, and insulin resistance: the role of intracellular magnesium. Am J Hypertens. 1997 Mar;10(3):346-55. doi: 10.1016/s0895-7061(96)00342-1. PMID: 9056694.
https://pubmed.ncbi.nlm.nih.gov/9056694/
60. Xu LH, Maalouf NM. Effect of acute hyperinsulinemia on magnesium homeostasis in humans. Diabetes Metab Res Rev. 2017 Feb;33(2). doi: 10.1002/dmrr.2844. Epub 2016 Sep 26. PMID: 27546733.
https://pubmed.ncbi.nlm.nih.gov/27546733/
61. Fraser WD, Taggart DP, Fell GS, Lyon TD, Wheatley D, Garden OJ, Shenkin A. Changes in iron, zinc, and copper concentrations in serum and in their binding to transport proteins after cholecystectomy and cardiac surgery. Clin Chem. 1989 Nov;35(11):2243-7. PMID: 2582624.
https://pubmed.ncbi.nlm.nih.gov/2582624/
62. Hennet T, Peterhans E, Stocker R. Alterations in antioxidant defences in lung and liver of mice infected with influenza A virus. J Gen Virol. 1992 Jan;73 ( Pt 1):39-46. doi: 10.1099/0022-1317-73-1-39. PMID: 1530963.
https://pubmed.ncbi.nlm.nih.gov/1530963/
63. Gaetke LM, McClain CJ, Talwalkar RT, Shedlofsky SI. Effects of endotoxin on zinc metabolism in human volunteers. Am J Physiol. 1997 Jun;272(6 Pt 1):E952-6. doi: 10.1152/ajpendo.1997.272.6.E952. PMID: 9227437.
https://pubmed.ncbi.nlm.nih.gov/9227437/
64. Oakes EJ, Lyon TD, Duncan A, Gray A, Talwar D, O'Reilly DS. Acute inflammatory response does not affect erythrocyte concentrations of copper, zinc and selenium. Clin Nutr. 2008 Feb;27(1):115-20. doi: 10.1016/j.clnu.2007.10.003. Epub 2007 Nov 26. PMID: 18037540.
https://pubmed.ncbi.nlm.nih.gov/18037540/
65. Foster M, Samman S. Zinc and regulation of inflammatory cytokines: implications for cardiometabolic disease. Nutrients. 2012 Jul;4(7):676-94. doi: 10.3390/nu4070676. Epub 2012 Jul 4. PMID: 22852057; PMCID: PMC3407988.
https://pubmed.ncbi.nlm.nih.gov/22852057/
66. Waldron JL, Ashby HL, Cornes MP, Bechervaise J, Razavi C, Thomas OL, Chugh S, Deshpande S, Ford C, Gama R. Vitamin D: a negative acute phase reactant. J Clin Pathol. 2013 Jul;66(7):620-2. doi: 10.1136/jclinpath-2012-201301. Epub 2013 Mar 1. PMID: 23454726.
https://pubmed.ncbi.nlm.nih.gov/23454726/
67. Nonnecke BJ, McGill JL, Ridpath JF, Sacco RE, Lippolis JD, Reinhardt TA. Acute phase response elicited by experimental bovine diarrhea virus (BVDV) infection is associated with decreased vitamin D and E status of vitamin-replete preruminant calves. J Dairy Sci. 2014 Sep;97(9):5566-79. doi: 10.3168/jds.2014-8293. Epub 2014 Jul 11. PMID: 25022687.
https://pubmed.ncbi.nlm.nih.gov/25022687/
68. Raiten DJ, Sakr Ashour FA, Ross AC, Meydani SN, Dawson HD, Stephensen CB, Brabin BJ, Suchdev PS, van Ommen B; INSPIRE Consultative Group. Inflammation and Nutritional Science for Programs/Policies and Interpretation of Research Evidence (INSPIRE). J Nutr. 2015 May;145(5):1039S-1108S. doi: 10.3945/jn.114.194571. Epub 2015 Apr 1. PMID: 25833893; PMCID: PMC4448820.
https://pubmed.ncbi.nlm.nih.gov/25833893/
69. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care. 2017 Dec 11;21(1):300. doi: 10.1186/s13054-017-1891-y. PMID: 29228951; PMCID: PMC5725835.
https://pubmed.ncbi.nlm.nih.gov/29228951/
70. Gombart AF, Pierre A, Maggini S. A Review of Micronutrients and the Immune System-Working in Harmony to Reduce the Risk of Infection. Nutrients. 2020 Jan 16;12(1):236. doi: 10.3390/nu12010236. PMID: 31963293; PMCID: PMC7019735.
https://pubmed.ncbi.nlm.nih.gov/31963293/
71. Schomburg L. Selenium Deficiency Due to Diet, Pregnancy, Severe Illness, or COVID-19-A Preventable Trigger for Autoimmune Disease. Int J Mol Sci. 2021 Aug 8;22(16):8532. doi: 10.3390/ijms22168532. PMID: 34445238; PMCID: PMC8395178.
https://pubmed.ncbi.nlm.nih.gov/34445238/
72. Fan L, Zhu X, Sun S, Yu C, Huang X, Ness R, Dugan LL, Shu L, Seidner DL, Murff HJ, Fodor AA, Azcarate-Peril MA, Shrubsole MJ, Dai Q. Ca:Mg ratio, medium-chain fatty acids, and the gut microbiome. Clin Nutr. 2022 Nov;41(11):2490-2499. doi: 10.1016/j.clnu.2022.08.031. Epub 2022 Sep 12. PMID: 36223712; PMCID: PMC9588659.
https://pubmed.ncbi.nlm.nih.gov/36223712/
73. Li Q, Chan H, Liu WX, Liu CA, Zhou Y, Huang D, Wang X, Li X, Xie C, Liu WY, Wang XS, Ng SK, Gou H, Zhao LY, Fong W, Jiang L, Lin Y, Zhao G, Bai F, Liu X, Chen H, Zhang L, Wong SH, Chan MTV, Wu WKK, Yu J. Carnobacterium maltaromaticum boosts intestinal vitamin D production to suppress colorectal cancer in female mice. Cancer Cell. 2023 Aug 14;41(8):1450-1465.e8. doi: 10.1016/j.ccell.2023.06.011. Epub 2023 Jul 20. PMID: 37478851.
https://pubmed.ncbi.nlm.nih.gov/37478851/
74. Sun E, Zhu X, Ness RM, Murff HJ, Sun S, Yu C, Fan L, Azcarate-Peril MA, Shrubsole MJ, Dai Q. Magnesium treatment increases gut microbiome synthesizing vitamin D and inhibiting colorectal cancer: results from a double-blind precision-based randomized placebo-controlled trial. Am J Clin Nutr. 2025 Nov;122(5):1185-1194. doi: 10.1016/j.ajcnut.2025.09.011. Epub 2025 Sep 12. PMID: 40946805.
https://pubmed.ncbi.nlm.nih.gov/40946805/
75. Chakraborty RK, Hamilton RJ. Calcium Channel Blocker Toxicity. [Updated 2023 Jul 28]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan.
https://www.ncbi.nlm.nih.gov/books/NBK537147/
76. Davis WB, Wells SR, Kuller JA, Thorp JM Jr. Analysis of the risks associated with calcium channel blockade: implications for the obstetrician-gynecologist. Obstet Gynecol Surv. 1997 Mar;52(3):198-201. doi: 10.1097/00006254-199703000-00023. PMID: 9061722.
https://pubmed.ncbi.nlm.nih.gov/9061722/