Metabole leververvetting is uitgegroeid tot de meest voorkomende leveraandoening in westerse landen. Naar schatting heeft een kwart tot een derde van de volwassen bevolking in meer of mindere mate last van leververvetting, vaak zonder het te weten. Juist dat maakt deze aandoening zo verraderlijk. In de vroege stadia veroorzaakt leververvetting doorgaans weinig tot geen klachten, terwijl intussen al belangrijke metabole processen ontsporen.

Metabole-disfunctie geAssocieerde Steatotische Leverziekte (MASLD), voorheen niet-alcoholische leververvetting (NAFLD) genoemd, is geen geïsoleerd leverprobleem. Het is een systemische aandoening die nauw samenhangt met insulineresistentie, chronische laaggradige ontsteking en verstoringen in het vet- en glucosemetabolisme. Daarmee vormt leververvetting een belangrijke risicofactor voor de ontwikkeling van diabetes type 2, cardiovasculaire aandoeningen en in een later stadium zelfs levercirrose en hepatocellulair carcinoom.1
In de vroege en matig gevorderde stadia is leververvetting grotendeels omkeerbaar. Dat vraagt alertheid op de mogelijke aanwezigheid en tijdige herkenning van vroege signalen. Steeds duidelijker wordt dat de darmmicrobiota een rol speelt in het ontstaan en in stand houden van leververvetting. Via de zogenoemde darm-leveras beïnvloeden darmbacteriën de metabole belasting, inflammatie en vetstapeling in de lever.2
In dit artikel wordt deze darm-leveras uitgediept, met specifieke aandacht voor de rol van de darmmicrobiota bij het ontstaan en de aanpak van leververvetting.
Tweerichtingsverkeer
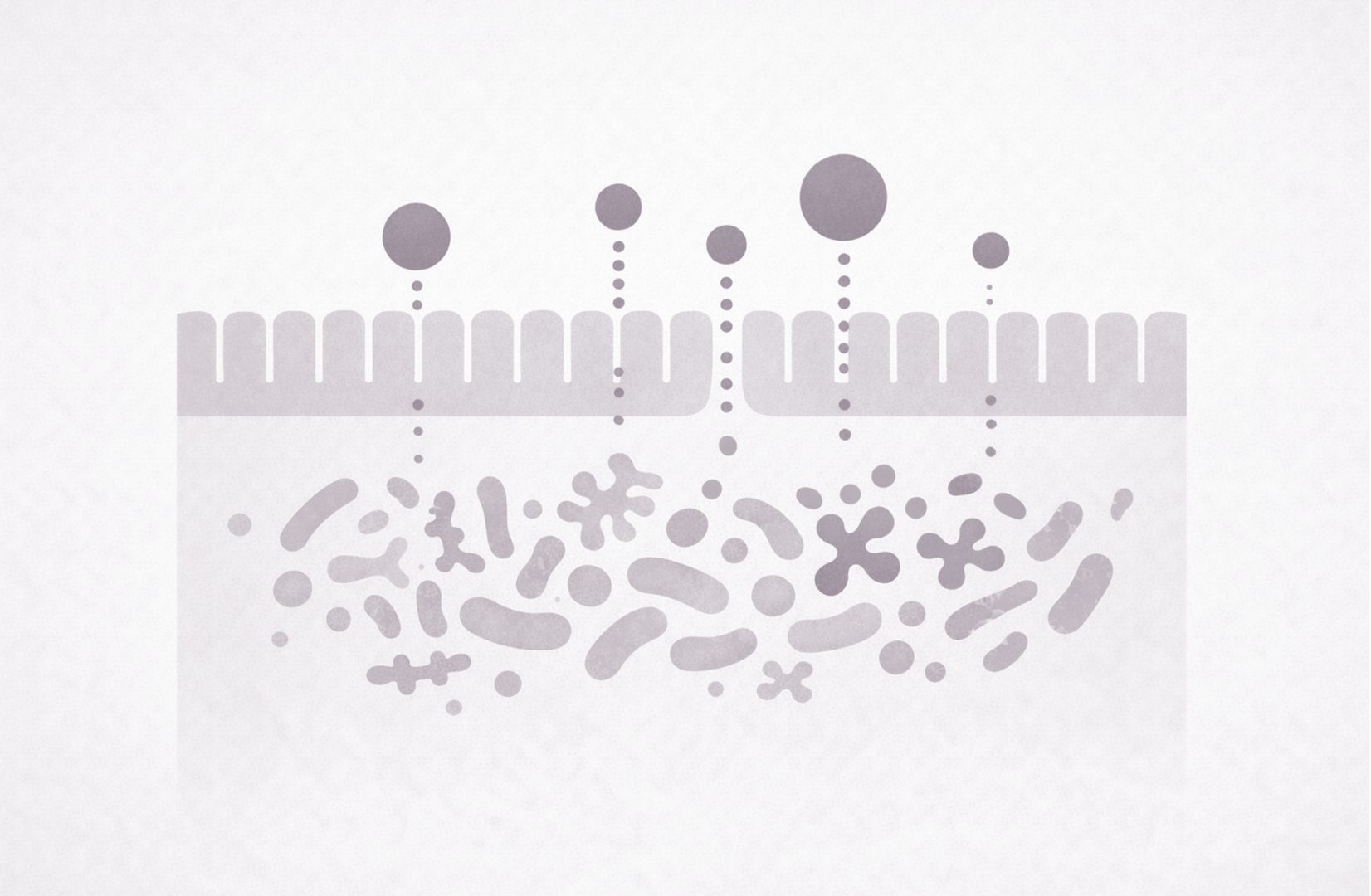
De anatomische en functionele verbinding tussen darm en lever wordt aangeduid als de darm-leveras. Deze as vormt een intensief communicatienetwerk waarin metabole, immunologische en hormonale signalen continu worden uitgewisseld.3 De centrale schakel hierin is de vena porta, de poortader, die bloed vanuit het maag-darmkanaal rechtstreeks naar de lever voert. Alles wat de darmbarrière passeert, bereikt daarmee in eerste instantie de lever.
Via deze route ontvangt de lever niet alleen voedingsstoffen, maar ook bacteriële metabolieten, fragmenten van micro-organismen en potentieel schadelijke stoffen zoals lipopolysacchariden (LPS, endotoxinen afkomstig van gram-negatieve bacteriën) en endogeen ethanol. De lever fungeert in dit proces als poortwachter. Hepatocyten (levercellen) en immuuncellen in de lever, zoals Kupffercellen, beoordelen deze aanvoer en reageren met een passende actie zoals detoxificatie, opslag, metabole verwerking of immuunactivatie.
Op zijn beurt stuurt de lever actief signalen terug naar de darm, via de productie en uitscheiding van galzuren en via de bloedcirculatie. Galzuren zijn niet alleen nodig voor vetvertering, maar functioneren ook als signaalmoleculen die de samenstelling en activiteit van de darmmicrobiota beïnvloeden. Daarnaast moduleert de lever via galzuren, ontstekingsstoffen zoals TNFα, IL6 en IL1β en immunologische signaalstoffen zoals CRP de darmbarrière en de immuunreactie in de darm.4
Dit tweerichtingsverkeer tussen darm en lever is onder fysiologische omstandigheden zorgvuldig gereguleerd. Een evenwichtige darmmicrobiota en een goed functionerende darmbarrière zorgen ervoor dat nutriënten selectief worden doorgelaten, terwijl de passage van bacteriële componenten en toxische stoffen tot een minimum beperkt blijft. Hierdoor is de metabole belasting van de lever beheersbaar en raakt zijn werking niet verstoord.
Microben als mede-regisseurs
De darmmicrobiota bestaat uit triljoenen micro-organismen die gezamenlijk een centrale rol spelen in de regulatie van metabole processen, immuunfunctie en barrièrefunctie van de darm. Niet alleen de samenstelling, maar vooral de functionele capaciteit van deze microbiota is bepalend voor de impact op de gezondheid. Een gezonde microbiota vormt een ecosysteem waarin microben in symbiose leven en waarin meerdere bacteriesoorten vergelijkbare gunstige functies kunnen vervullen, zoals de productie van korteketenvetzuren, ondersteuning van de darmbarrière en modulatie van ontstekingsprocessen.
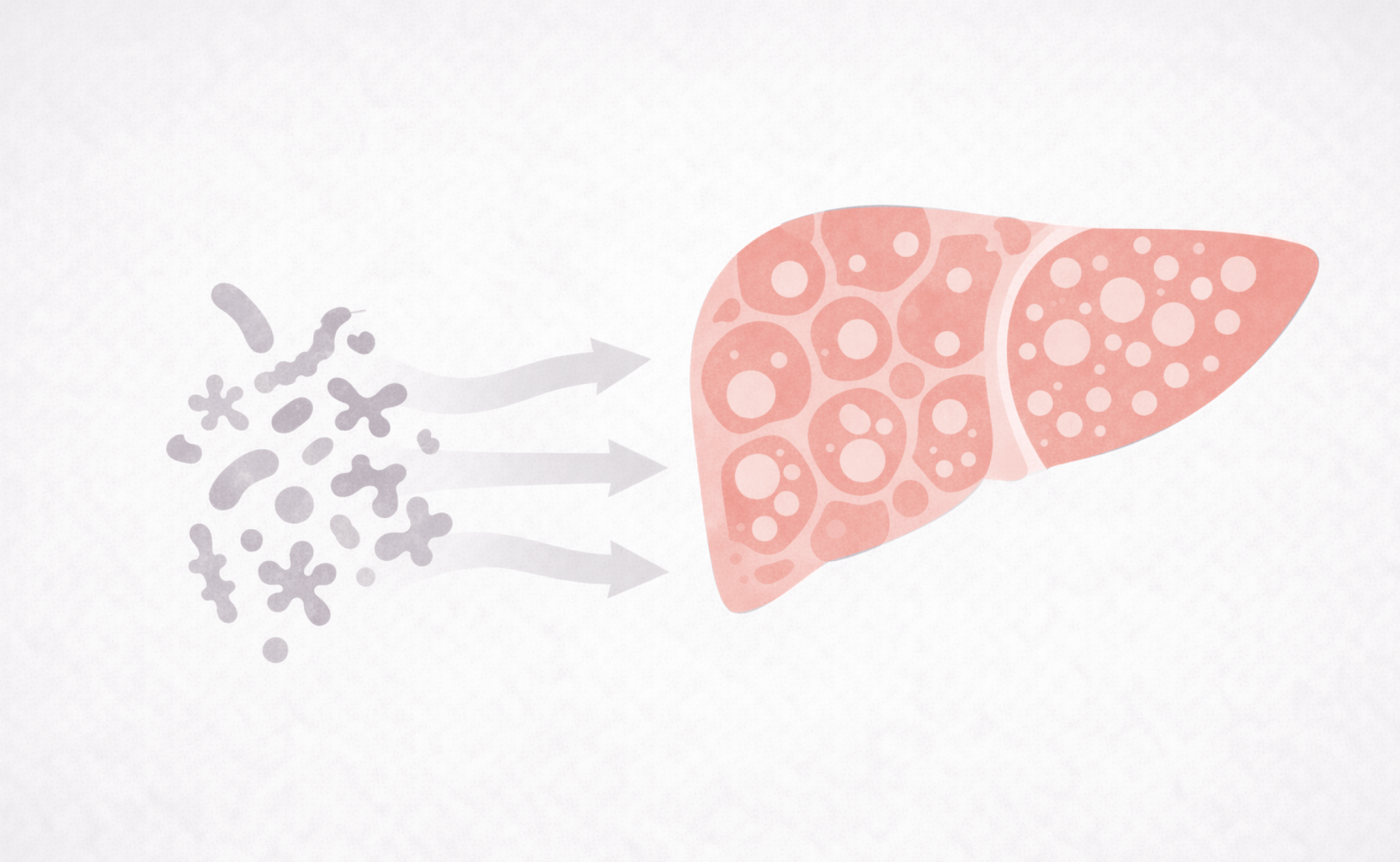
Bij dysbiose raakt dit evenwicht verstoord. Verschillende studies beschrijven een typische microbioomsignatuur (een soort microbiële vingerafdruk) bij leververvetting. Zo worden lagere aantallen gunstige butyraatproducerende bacteriën gezien, waaronder Faecalibacterium prausnitzii en Roseburia-soorten. Tegelijkertijd neemt de aanwezigheid toe van bacteriegroepen die geassocieerd zijn met schadelijke endotoxineproductie en ethanolvorming, zoals bepaalde Enterobacteriaceae.5 Deze microbiële veranderingen beïnvloeden niet alleen de belasting van de lever, maar versterken met behulp van metabolieten en signaalstoffen ook insulineresistentie en laaggradige ontsteking, verstoren het galzuurmetabolisme en kunnen uiteindelijk resulteren in leverziekte.6-8
Deze vicieuze cirkel vormt een belangrijk mechanistisch fundament onder het ontstaan van leververvetting en verklaart waarom darmgezondheid een sleutelrol speelt in zowel preventie als behandeling van leververvetting.
Van darmprobleem naar leverziekte
Bij aanhoudende verstoring van de darm-leveras wordt de lever voortdurend blootgesteld aan inflammatoire prikkels vanuit de darm, waaronder LPS en endogeen ethanol. Deze stoffen bereiken via de poortader rechtstreeks de lever en activeren daar de Kupffercellen. Deze voortdurende activatie heeft een toestand van lage maar chronische immuunactiviteit in de lever tot gevolg. Kupffercellen produceren daarbij pro-inflammatoire cytokinen zoals TNFα en IL6 en stimuleren de vorming van vrije radicalen (reactieve zuurstofmoleculen), wat leidt tot oxidatieve stress.9,10 Bij oxidatieve stress is de natuurlijke antioxidatieve capaciteit van de lever onvoldoende in staat om de toename van vrije radicalen het hoofd te bieden. Hierdoor ontstaat schade aan levercellen, die op zijn beurt de ontstekingsreactie in de lever aanwakkert.
Zowel ontstekingsmediatoren als vrije zuurstofradicalen grijpen vervolgens in op de intracellulaire signaalroutes die de leverstofwisseling aansturen. Met name de insulinesignalering raakt verstoord. Onder fysiologische omstandigheden remt insuline in de lever de glucoseproductie en stimuleert het een evenwichtige verwerking van vetzuren. Ontsteking en stress kunnen de werking van insuline kortdurend verminderen door de aanvoer van ontstekingsmediatoren en verhoogde productie van vrije zuurstofradicalen.11 Dit is een functioneel en beschermend systeem van insulineresistentie, omdat het leidt tot de beschikbaarheid van glucose en andere energiebronnen om een acute dreiging, zoals infectie of weefselschade, het hoofd te bieden. Wanneer deze remming van insuline echter voortduurt door aanhoudende aanwezigheid van ontstekingsmediatoren en oxidatieve stress, werkt dit systeem averechts. De glucoseproductie in de lever blijft verhoogd en er ontstaat een toestand van hyperglykemie. De alvleesklier reageert op de verhoogde hoeveelheid glucose in het bloed met extra aanmaak en afgifte van insuline. In de lever kan deze extra insuline niet goed worden verwerkt, waardoor insuline blijft circuleren zonder het gewenste effect. Hierdoor ontstaat naast hyperglykemie in de lever ook hyperinsulinemie, met als gevolg dat hepatocyten steeds minder adequaat reageren op insuline en steeds meer insulineresistent worden.12-14
De verhoogde aanmaak van insuline door de alvleesklier heeft niet enkel effect op de lever. Ook in andere delen van het lichaam kan hierdoor insulineresistentie ontstaan. Vooral vetweefsel is daar gevoelig voor. In vetweefsel zorgt insuline voor de regulatie van afbraak en opslag van vetzuren. Als dit proces wordt verstoord, komen meer vrije vetzuren uit vetweefsel in de bloedcirculatie, die via de poortader de lever bereiken. Normaliter worden deze vetzuren in de lever verbrand en omgezet in energie, maar in een situatie van chronische ontsteking, oxidatieve stress en insulineresistentie is de lever daar minder goed toe in staat.15 Paradoxaal genoeg stimuleert deze situatie de-novo-lipogenese, de nieuwvorming van vet in de lever, onder invloed van insuline. Deze situatie kan ontstaan doordat niet alle functies van insuline worden geremd; de insulineroutes die de vethuishouding raken, blijven deels functioneren.16 Dit wordt selectieve insulineresistentie genoemd. Door deze combinatie van verhoogde vetaanvoer, verminderde vetverbranding en aanhoudende vetaanmaak ontstaat een situatie waarin vetten niet langer worden afgevoerd, maar zich ophopen in hepatocyten. Langzaam maar zeker ontstaat zo vetstapeling in de lever, het kenmerkende beeld van leververvetting.
In eerste instantie is deze vetstapeling nog functioneel en omkeerbaar. Wanneer de prikkel vanuit de darm echter aanhoudt, neemt schade in de lever toe. Dit leidt tot activatie van stellaatcellen in de lever, die een rol spelen in de vorming van bindweefsel en daarmee in het ontstaan van fibrose.17 Fibrose markeert een belangrijk kantelpunt. Fibrose is slechts deels herstelbaar en kan overgaan in cirrose, het eindstadium van chronische leverziekte. In dit stadium is sprake van onomkeerbare structurele schade, met verlies van functioneel leverweefsel en een sterk verhoogd risico op complicaties zoals portale hypertensie en hepatocellulair carcinoom.18
Leververvetting is een langzaam proces dat gedurende vele jaren een geleidelijke progressie kent. Dit onderstreept het belang van vroege herkenning en interventie. Door vroegtijdig in te grijpen op darmgezondheid en leefstijl kan het proces vaak worden afgeremd of zelfs teruggedraaid voordat onomkeerbare schade optreedt.
Tijdige herkenning
Leververvetting blijft in de dagelijkse praktijk vaak onder de radar. Patiënten presenteren zich niet met typische leverklachten, maar met aspecifieke symptomen of metabole problematiek. Dat vraagt van de behandelaar een scherp oog voor patroonherkenning. In de vroege stadia is leververvetting meestal symptoomloos. Leververvetting past in een breder patroon van metabole ontregeling. Wanneer klachten optreden, zijn deze vaak vaag en niet specifiek, zoals energiedips, vermoeidheid, concentratieproblemen, stemmingsklachten, hormonale klachten, darmklachten, verhoogde bloeddruk en een vol of drukkend gevoel rechtsboven in de buik.
Leverenzymen zoals ALAT en ASAT worden vaak gebruikt als screeningsinstrument, maar zijn beperkt betrouwbaar. Een aanzienlijk deel van de mensen met leververvetting heeft normale leverwaarden. Een lichte verhoging van ALAT, een verhoogde gamma-GT of een verstoorde triglyceriden-HDL-ratio kan echter wel richtinggevend zijn, vooral in combinatie met tekenen van insulineresistentie zoals verhoogde nuchtere glucose, insuline of HbA1c.19,20 De middelomtrek is in de praktijk een waardevolle en laagdrempelige indicator. Abdominale vetopslag correleert sterk met leververvetting, onafhankelijk van BMI.21 Een toenemende buikomvang, zeker in combinatie met een stabiel lichaamsgewicht, verdient daarom altijd aandacht.
Leefstijlaanpassing
Omdat leververvetting het resultaat is van langdurige metabole en inflammatoire ontregeling, ligt de sleutel tot herstel in een integrale leefstijlaanpak.22,23 Interventies zijn daarbij gelijktijdig effectief voor de lever en de darmmicrobiota en daarmee voor herstel van de darm-leveras.
Voeding
Voeding vormt de basis van elke interventie bij leververvetting. Een voedingspatroon dat insulineresistentie vermindert, ontstekingen remt en de microbiota ondersteunt, remt ook de belasting van de lever. Dit betekent in de praktijk een sterke reductie van snel opneembare koolhydraten, fructoserijke producten en sterk bewerkte voeding. Vezelrijke voeding uit groenten, noten, zaden en in beperkte mate fruit helpt de microbiële balans in de darm herstellen, stimuleert de productie van gunstige bacteriële metabolieten en versterkt de darmbarrière. Daarnaast ondersteunen bittere groenten en eiwitrijke voeding de galproductie en leverfunctie.24-26 Het doel is niet primair calorierestrictie, maar metabole ontlasting. Er kan in dit verband ook gedacht worden aan een voedingspatroon waarmee voedingsketose wordt bereikt. Bij voedingsketose schakelt het lichaam door lage koolhydraatinname over van glucoseverbranding naar vet- en ketonverbranding. Dit is gunstig omdat hiermee de onderliggende metabole ontregeling wordt aangepakt.27,28
Lichaamsbeweging
Regelmatige lichaamsbeweging verbetert de insulinegevoeligheid, onafhankelijk van gewichtsverlies.29 Zowel aerobe training als krachttraining dragen bij aan vermindering van levervet. Spieractiviteit verlaagt de glucosebelasting van de lever doordat spieren glucose verbruiken en beïnvloedt bovendien de samenstelling van de darmmicrobiota in gunstige zin.30 Dagelijkse beweging verdient hierbij de voorkeur boven incidentele intensieve inspanning. Ook de combinatie van voeding (specifiek het mediterraan dieet) en beweging laat positieve effecten zien op leververvetting.31
Slaap en stress
Slaap en stress spelen een actieve en vaak onderschatte rol bij het ontstaan en de progressie van leververvetting.32,33 Chronisch slaaptekort verhoogt de productie van ontstekingsstoffen en verstoort het circadiane ritme, terwijl de lever juist sterk afhankelijk is van een goed afgestemde biologische klok voor de regulatie van vet- en suikerstofwisseling.34,35 Daarnaast ontregelt onvoldoende slaap de balans tussen honger- en verzadigingshormonen, waardoor de neiging tot overeten en voorkeur voor suikerrijke voeding toenemen, met extra vetopslag in de lever als gevolg. Chronische stress versterkt deze processen verder via langdurig verhoogde cortisolspiegels, die insulineresistentie en abdominale vetopslag bevorderen. Tegelijkertijd beïnvloedt stress de samenstelling van de darmmicrobiota en de integriteit van de darmbarrière negatief, waardoor meer inflammatoire prikkels de lever bereiken.36 Aandacht voor slaaphygiëne en stressregulatie zijn daarom belangrijke pijlers in de behandeling.
Darm
Interventies specifiek gericht op de darmmicrobiota kunnen een waardevolle aanvulling zijn. Probiotica en prebiotische voeding kunnen bijdragen aan herstel van microbiële diversiteit, vermindering van endotoxinebelasting, verbetering van de darmbarrière en verbetering van het galzuurmetabolisme.37,38 De keuze voor interventies is idealiter gebaseerd op klachtenpatronen en metabole context van het individu en niet op een generieke benadering.
Het kenmerkende van deze leefstijlinterventies is hun dubbele effect. Ze verlagen enerzijds de metabole belasting van de lever en verbeteren anderzijds de darmgezondheid. Juist deze gecombineerde aanpak maakt het mogelijk om leververvetting in een vroeg stadium daadwerkelijk om te keren en progressie naar fibrose of cirrose te voorkomen.
Conclusie
Leververvetting is een wijdverspreide, vaak onderschatte metabole aandoening die zelden op zichzelf staat. De pathofysiologie weerspiegelt een bredere ontregeling van metabole, inflammatoire en microbiële processen. De darm-leveras vormt hierin een centraal aangrijpingspunt. Via deze as beïnvloeden veranderingen in de darmmicrobiota, darmdoorlaatbaarheid en microbiële metabolieten direct de metabole belasting en ontstekingsactiviteit in de lever. In de vroege stadia is leververvetting in veel gevallen omkeerbaar. Een integrale leefstijlaanpak, gericht op voeding, beweging, slaap, stressregulatie en ondersteuning van de darmmicrobiota, vormt daarbij de kern. Door in te grijpen op de darm-leveras wordt niet alleen de levergezondheid hersteld, maar ook het metabole evenwicht duurzaam verbeterd.
- Gallo G, Nalli G, Baratta F, et al. Metabolic Dysfunction-Associated Steatotic Liver Disease: A Silent Driver of Cardiovascular Risk and a New Target for Intervention. Int J Mol Sci. 2025 Aug 21;26(16):8081.
- Tripathi A, Debelius J, Brenner DA, et al. The gut-liver axis and the intersection with the microbiome. Nat Rev Gastroenterol Hepatol. 2018 Jul;15(7):397-411. Erratum in: Nat Rev Gastroenterol Hepatol. 2018 Dec;15(12):785.
- Albillos A, de Gottardi A, Rescigno M. The gut-liver axis in liver disease: Pathophysiological basis for therapy. J Hepatol. 2020 Mar;72(3):558-577.
- Anand S, Mande SS. Host-microbiome interactions: Gut-Liver axis and its connection with other organs. NPJ Biofilms Microbiomes. 2022 Nov 1;8(1):89.
- Aron-Wisnewsky J, Vigliotti C, Witjes J, et al. Gut microbiota and human NAFLD: disentangling microbial signatures from metabolic disorders. Nat Rev Gastroenterol Hepatol. 2020 May;17(5):279-297.
- Pezzino S, Sofia M, Mazzone C, et al. Gut Microbiome in the Progression of NAFLD, NASH and Cirrhosis, and Its Connection with Biotics: A Bibliometric Study Using Dimensions Scientific Research Database. Biology (Basel). 2023 Apr 27;12(5):662.
- Koning M, Herrema H, Nieuwdorp M, et al. Targeting nonalcoholic fatty liver disease via gut microbiome-centered therapies. Gut Microbes. 2023 Jan-Dec;15(1):2226922.
- Mpountouridis A, Tsigalou C, Bezirtzoglou I, et al. Gut microbiome in non-alcoholic fatty liver disease. Front. Gastroenterol., 14 January 2025. Sec. Hepatology Volume 3 – 2024.
- Slevin E, Baiocchi L, Wu N, et al. Kupffer Cells: Inflammation Pathways and Cell-Cell Interactions in Alcohol-Associated Liver Disease. Am J Pathol. 2020 Nov;190(11):2185-2193.
- Wang J, Wang X, Zhuo E, et al. Gut‑liver axis in liver disease: From basic science to clinical treatment (Review). Mol Med Rep. 2025 Jan;31(1):10.
- Gao ZG, Ye JP. Why do anti-inflammatory therapies fail to improve insulin sensitivity? Acta Pharmacol Sin. 2012 Feb;33(2):182-8.
- Vesković M, Šutulović N, Hrnčić D, et al. The Interconnection between Hepatic Insulin Resistance and Metabolic Dysfunction-Associated Steatotic Liver Disease-The Transition from an Adipocentric to Liver-Centric Approach. Curr Issues Mol Biol. 2023 Nov 14;45(11):9084-9102.
- Onyango AN. Excessive gluconeogenesis causes the hepatic insulin resistance paradox and its sequelae. Heliyon. 2022 Dec 15;8(12):e12294.
- Truong XT, Lee DH. Hepatic Insulin Resistance and Steatosis in Metabolic Dysfunction-Associated Steatotic Liver Disease: New Insights into Mechanisms and Clinical Implications. Diabetes Metab J. 2025 Sep;49(5):964-986.
- Mu W, Cheng XF, Liu Y, et al. Potential Nexus of Non-alcoholic Fatty Liver Disease and Type 2 Diabetes Mellitus: Insulin Resistance Between Hepatic and Peripheral Tissues. Front Pharmacol. 2019 Jan 14;9:1566.
- Bo T, Gao L, Yao Z, et al. Hepatic selective insulin resistance at the intersection of insulin signaling and metabolic dysfunction-associated steatotic liver disease. Cell Metab. 2024 May 7;36(5):947-968.
- Wang M, Li L, Xu Y, et al. Roles of hepatic stellate cells in NAFLD: From the perspective of inflammation and fibrosis. Front Pharmacol. 2022 Oct 13;13:958428.
- Zhang CY, Yuan WG, He P, et al. Liver fibrosis and hepatic stellate cells: Etiology, pathological hallmarks and therapeutic targets. World J Gastroenterol. 2016 Dec 28;22(48):10512-10522.
- Wang J, Li H, Wang X, et al. Association between triglyceride to high-density lipoprotein cholesterol ratio and nonalcoholic fatty liver disease and liver fibrosis in American adults: an observational study from the National Health and Nutrition Examination Survey 2017-2020. Front Endocrinol (Lausanne). 2024 Jul 16;15:1362396.
- Wu KT, Kuo PL, Su SB, et al. Nonalcoholic fatty liver disease severity is associated with the ratios of total cholesterol and triglycerides to high-density lipoprotein cholesterol. J Clin Lipidol. 2016 Mar-Apr;10(2):420-5.e1.
- van Kleef LA, Michel M, Savas M, et al. A Comparison of the Predictive Value of 12 Body Composition Markers for Metabolic Dysfunction-Associated Steatotic Liver Disease, At-Risk Metabolic Dysfunction-Associated Steatohepatitis, and Increased Liver Stiffness in a General Population Setting. Am J Gastroenterol. 2025 Jul 23.
- Ezzat WM. Impact of lifestyle interventions on pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2024 May 28;30(20):2633-2637.
- Chai XN, Zhou BQ, Ning N, et al. Effects of lifestyle intervention on adults with metabolic associated fatty liver disease: A systematic review and meta-analysis. Front Endocrinol (Lausanne). 2023 Feb 16;14:1081096.
- Romero-Gómez M, Zelber-Sagi S, Martín F, et al. Nutrition could prevent or promote non-alcoholic fatty liver disease: an opportunity for intervention. BMJ. 2023 Oct 9;383:e075179.
- Simancas-Racines D, Annunziata G, Verde L, et al. Nutritional Strategies for Battling Obesity-Linked Liver Disease: the Role of Medical Nutritional Therapy in Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) Management. Curr Obes Rep. 2025 Jan 11;14(1):7.
- Liu J, Li C, Yang Y, et al. Special correlation between diet and MASLD: positive or negative? Cell Biosci. 2025 Apr 12;15(1):44.
- Kelty TJ, Krause AA, Rector RS. Ketone metabolites in metabolic dysfunction-associated steatotic liver disease progression: optimizing keto-therapeutic strategies. Am J Physiol Endocrinol Metab. 2025 Aug 1;329(2):E290-E301.
- Emanuele F, Biondo M, Tomasello L, et al. Ketogenic Diet in Steatotic Liver Disease: A Metabolic Approach to Hepatic Health. Nutrients. 2025 Apr 4;17(7):1269.
- Stine JG, DiJoseph K, Pattison Z, et al. Exercise Training Is Associated With Treatment Response in Liver Fat Content by Magnetic Resonance Imaging Independent of Clinically Significant Body Weight Loss in Patients With Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. Am J Gastroenterol. 2023 Jul 1;118(7):1204-1213.
- Sokal-Dembowska A, Polak-Szczybyło E, Helma K, et al. Physical Activity and Metabolic Disorders-What Does Gut Microbiota Have to Do with It? Curr Issues Mol Biol. 2025 Aug 7;47(8):630.
- Arita VA, Cabezas MC, Hernández Vargas JA, et al.; GRIPonMASH Consortium. Effects of Mediterranean diet, exercise, and their combination on body composition and liver outcomes in metabolic dysfunction-associated steatotic liver disease: a systematic review and meta-analysis of randomized controlled trials. BMC Med. 2025 Aug 27;23(1):502.
- Bu LF, Xiong CY, Zhong JY, et al. Non-alcoholic fatty liver disease and sleep disorders. World J Hepatol. 2024 Mar 27;16(3):304-315.
- Xu MY, Guo CC, Li MY, et al. Brain-gut-liver axis: Chronic psychological stress promotes liver injury and fibrosis via gut in rats. Front Cell Infect Microbiol. 2022 Dec 12;12:1040749.
- Sun Z, Ji J, Zuo L, et al. Causal relationship between nonalcoholic fatty liver disease and different sleep traits: a bidirectional Mendelian randomized study. Front Endocrinol (Lausanne). 2023 Jun 2;14:1159258.
- Weng Z, Ou W, Huang J, et al. Circadian Misalignment Rather Than Sleep Duration is Associated with MAFLD: A Population-Based Propensity Score-Matched Study. Nat Sci Sleep. 2021 Jan 29;13:103-111.
- Madison AA, Bailey MT. Stressed to the Core: Inflammation and Intestinal Permeability Link Stress-Related Gut Microbiota Shifts to Mental Health Outcomes. Biol Psychiatry. 2024 Feb 15;95(4):339-347.
- Huang Y, Wang X, Zhang L, et al. Effect of Probiotics Therapy on Nonalcoholic Fatty Liver Disease. Comput Math Methods Med. 2022 May 30;2022:7888076.
- Yao Y, Hong Q, Ding S, et al.. An umbrella review of meta-analyses on the effects of microbial therapy in metabolic dysfunction-associated steatotic liver disease. Clin Nutr. 2025 Apr;47:1-13.